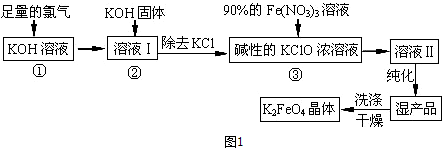
题目内容
4.2Zn(OH)2•ZnCO3是制备活性ZnO的中间体,以锌焙砂(主要成分为ZnO,含少量Cu2+、Mn2+等离子)为原料制备2Zn(OH)2•ZnCO3的工艺流程如图:
请回答下列问题:
(1)(NH4)2SO4与NH3•H2O组成的混合溶液工业上称为缓冲溶液,向该溶液中加入少量强酸或强碱,溶液的PH都不会有明显变化,请分别用离子方程式说明原因NH3•H2O+H+=NH4++H2O,NH4++OH-=NH3•H2O.
(2)“浸取”时为了加快锌的浸出速率,可采取的措施有将锌焙砂粉碎;搅拌;适当加热提高浸取温度等(任写两种);
(3)“浸取”时加入的NH3•H2O过量,写出生成MnO2的离子方程式Mn2++H2O2+2NH3•H2O=MnO2↓+2NH4++2H2O;
(4)适量S2-能将Cu2+转化为硫化物沉淀而除去,若选择ZnS进行除杂,是否可行?可行;用计算说明原因:ZnS+Cu2+=CuS+Zn2+K=$\frac{Ksp(ZnS)}{Ksp(CuS)}$=1.2×1012>1×105反应趋于完全;[已知:Ksp(ZnS)=1.6×l0-24,Ksp(CuS)=1.3×l0-36
(5)“沉锌”的离子方程式是3Zn2++6HCO3-=2Zn(OH)2•ZnCO3↓+5CO2↑+H2O;
(6)该过程中,蒸氨所得氨气可循环利用,“过滤 III”所得滤液也可循环使用,其主要成分的化学式是(NH4)2SO4.
分析 制备2Zn(OH)2•ZnCO3流程为:锌焙砂(主要成分为ZnO,含少量Cu2+、Mn2+等离子)中加入硫酸铵、氨水、双氧水,双氧水将锰离子氧化成二氧化锰:Mn2++H2O2+2NH3•H2O=MnO2↓+2 NH4++2H2O,过滤后在滤液中加硫化铵,再过滤,除去铜离子,蒸氨除去多余的氨气,加入碳酸氢铵得到2Zn(OH)2•ZnCO3和二氧化碳气体,过滤得2Zn(OH)2•ZnCO3,滤液为硫酸铵溶液,
(1)加碱时,NH4+与氢氧根离子生成NH3•H2O,加酸时,NH3•H2O 与氢离子生成NH4+;
(2)根据影响反应速率的因素判断“浸取”时为了提高锌的浸出率,可采取的措施;
(3)“浸取”时加入的NH3•H2O过量,溶液呈碱性,双氧水将锰离子氧化成MnO2,根据电荷守恒和元素守恒书写离子方程式;
(4)根据反应ZnS+Cu2+=CuS+Zn2+,可知K=$\frac{Ksp(ZnS)}{Ksp(CuS)}$=1.2×1012,结合题中信息可判断ZnS除杂,是否可行;
(5)“沉锌”的过程为溶液中的锌离子与碳酸氢铵溶液反应生成2Zn(OH)2•ZnCO3,据此书写离子方程式;
(6)“过滤3”所得滤液为硫酸铵溶液,可循环使用.
解答 解:(1)(NH4)2SO4与NH3•H2O组成的混合溶液中加酸:NH3•H2O+H+=NH4++H2O,加碱:NH4++OH-=NH3•H2O,溶液的PH都不会有明显变化;
故答案为:NH3•H2O+H+=NH4++H2O,NH4++OH-=NH3•H2O;
(2)根据影响反应速率的因素判断“浸取”时为了提高锌的浸出率,可采取的措施为将锌焙砂粉碎;搅拌;适当加热提高浸取温度等;
故答案为:将锌焙砂粉碎;搅拌;适当加热提高浸取温度等;
(3)“浸取”时加入的NH3•H2O过量,溶液呈碱性,双氧水将锰离子氧化成MnO2,反应的离子方程式为Mn2++H2O2+2NH3•H2O=MnO2↓+2NH4++2H2O;
故答案为:Mn2++H2O2+2NH3•H2O=MnO2↓+2 NH4++2H2O;
(4)根据反应ZnS+Cu2+=CuS+Zn2+,可知K=$\frac{Ksp(ZnS)}{Ksp(CuS)}$=1.2×1012>>1×105,K>105化学反应完全,所以选择ZnS进行除杂是可行的;
故答案为:可行;ZnS+Cu2+=CuS+Zn2+ K=$\frac{Ksp(ZnS)}{Ksp(CuS)}$=1.2×1012>1×105反应趋于完全;
(5)“沉锌”的过程为溶液中的锌离子与碳酸氢铵溶液反应生成2Zn(OH)2•ZnCO3,离子方程式为3Zn2++6HCO3-=2Zn(OH)2•ZnCO3↓+5CO2↑+H2O;
故答案为:3Zn2++6HCO3-=2Zn(OH)2•ZnCO3↓+5CO2↑+H2O;
(6)“过滤3”所得滤液为硫酸铵溶液,可循环使用,其化学式为(NH4)2SO4;
故答案为:(NH4)2SO4.
点评 本题考查了物质制备方案的设计、物质分离与提纯方法的综合应用,题目难度较大,明确制备流程为解答关键,注意掌握常见物质分离与提纯的操作方法,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力及化学实验能力.

 阅读快车系列答案
阅读快车系列答案| A. | 113号元素的氧化物为碱性氧化物 | |
| B. | 115号元素位于第七周期VA族 | |
| C. | 含176个中子的Ts原子表示为${\;}_{117}^{176}$Ts | |
| D. | 118号元素的原子最外层有8个电子 |
 25℃时,FeS和ZnS的饱和溶液中,金属阳离子与S2-的物质的量浓度的负对数关系如图所示.下列说法正确的是( )
25℃时,FeS和ZnS的饱和溶液中,金属阳离子与S2-的物质的量浓度的负对数关系如图所示.下列说法正确的是( )| A. | 溶解度S(FeS)<S(ZnS) | |
| B. | a点表示FeS的不饱和溶液,且c(Fe2+)>c(S2-) | |
| C. | 向b点对应溶液中加入Na2S溶液,可转化为c点对应的溶液 | |
| D. | 向c点对应的溶液中加入Na2S溶液,ZnS的KSP增大 |
| A. | a、c、d均存在两种以上的氧化物 | |
| B. | b的氧化物与d的最高价氧化物对应水化物反应后的溶液呈酸性 | |
| C. | a是短周期中金属性最强的元素 | |
| D. | 工业上是通过电解b、d形成的化合物制取b单质 |
| A. | 乙烷中混有乙烯可用酸性高锰酸钾溶液来除去 | |
| B. | 在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 | |
| C. | 已知2SO2(g)+O2(g)?2SO3(g)△H<0,该反应在任何温度下均可自发进行 | |
| D. | 室温下,Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=9.0×10-12,向浓度相等的Na2CrO4和NaCl的混合稀溶液中滴加0.01 mol•L-1 AgNO3溶液,先生成Ag2CrO4沉淀 |
| A. | 0.1mol•L-1NaHC2O4溶液(pH=5.5):c(Na+)>c(HC2O4-)>c(C2O42-)>c(H2C2O4) | |
| B. | 0.1mol•L-1NaHS溶液:c(OH-)+c(S2-)=c(H+)+c(H2S) | |
| C. | 0.1mol•L-1CH3COOH溶液和0.1mol•L-1CH3COONa溶液等体积混合:c(Na+)>c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) | |
| D. | 0.1mol•L-1NH4HSO4溶液中滴加0.1mol•L-1NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) |
 乙烯催化氧化成乙醛可设计成如图所示的燃料电池,已知其总反应方程式为:2CH2═CH2+O22CH3CHO.则下列有关说法不正确的是( )
乙烯催化氧化成乙醛可设计成如图所示的燃料电池,已知其总反应方程式为:2CH2═CH2+O22CH3CHO.则下列有关说法不正确的是( )| A. | 该装置能量转化形式试点能转化为化学能 | |
| B. | 电子移动方向:电极a磷酸溶液电极b | |
| C. | 每有0.1mol O2反应,则向负极迁移的H+的物质的量为0.2mol | |
| D. | 负极反应式:CH2=CH2-2e-+H2O═CH3CHO+2H+ |
 设计如图所示实验装置,夹子在实验开始时处于关闭状态,将液体A滴入烧瓶与气体B充分反应;当打开夹子后发现试管内的水立刻沸腾.则液体A和气体B的组合不可能是( )
设计如图所示实验装置,夹子在实验开始时处于关闭状态,将液体A滴入烧瓶与气体B充分反应;当打开夹子后发现试管内的水立刻沸腾.则液体A和气体B的组合不可能是( )| A. | 水、氯化氢 | B. | 稀硫酸、氨气 | ||
| C. | 氢氧化钠溶液、SO2 | D. | 氢氧化钠溶液、CO |