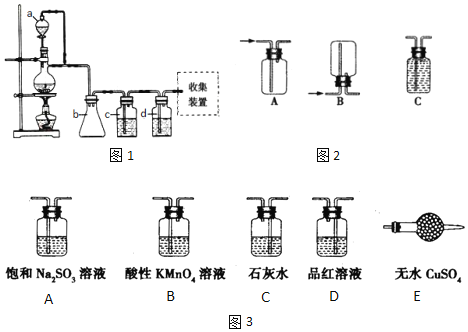
题目内容
【题目】化合物ZYX4是在化工领域有着重要应用价值的离子化合物,电子式如图所示。X、Y、Z是原子序数依次增大的短周期元素,其中只有一种为金属元素,X是周期表中原子半径最小的元素。下列叙述中错误的是 ( )

A.Z是短周期元素中金属性最强的元素
B.Y的最高价氧化物对应水化物呈弱酸性
C.X、Y可以形成分子式为YX3的稳定化合物
D.化合物ZYX4有强还原性
【答案】C
【解析】
X原子半径最小,故为H;由YH4-可知Y最外层电子数为8-4(4个氢原子的电子)-1(得到的1个电子)=3,即Y最外层有3个电子,Y可能为B或Al;Z显+1价,故为第IA族的金属元素,X、Y、Z是原子序数依次增大的短周期元素,因为只有一种为金属元素,故Y为B、Z为Na,则
A.钠是短周期元素中金属性最强的元素A正确;
B.硼的最高价氧化物对应水化物是硼酸,呈弱酸性,B正确;
C.BH3中B的非金属性弱且BH3为缺电子结构,B的气态氢化物为多硼烷,如乙硼烷等,故BH3不是稳定的气态氢化物,C错误;
D.NaBH4中的H为-1价,故有强还原性,D正确;
答案选C。

 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案【题目】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
(1)下图是N2(g)和H2(g)反应生成1molNH3(g)过程中能量的变化示意图,请写出N2和H2反应的热化学方程式:___________________。

(2)若已知下列数据:
化学键 | H—H | N≡N |
键能/kJ·mol-1 | 435 | 943 |
试根据表中及图中数据计算N—H的键能:________kJ·mol-1。
(3)用NH3催化还原NOx还可以消除氮氧化物的污染。
已知:①4NH3(g)+3O2(g)═2N2(g)+6H2O(g) ΔH1=-akJ·mol-1
②N2(g)+O2(g)═2NO(g) ΔH2=-bkJ·mol-1
若1molNH3还原NO至N2,则该反应过程中的热化学方程式:________。(用含a、b的式子表示ΔH3)。
(4)捕碳技术(主要指捕获CO2)在降低温室气体排放中具有重要的作用。目前NH3和(NH4)2CO3已经被用作工业捕碳剂,它们与CO2可发生如下可逆反应:
反应 Ⅰ:2NH3(l)+H2O(l)+CO2(g)![]() (NH4)2CO3(aq) ΔH1
(NH4)2CO3(aq) ΔH1
反应 Ⅱ:NH3(l)+H2O(l)+CO2(g)![]() NH4HCO3(aq) ΔH2
NH4HCO3(aq) ΔH2
反应Ⅲ:(NH4)2CO3(aq)+H2O(l)+CO2(g)![]() 2NH4HCO3(aq) ΔH3
2NH4HCO3(aq) ΔH3
则ΔH3与ΔH1、ΔH2之间的关系是ΔH3=________________。