��Ŀ����
����Ŀ���������������ǵij��д����˼���IJ��㣬����о�NO2��SO2�ȴ�����Ⱦ��Ĵ���������Ҫ���塣
(1)ij�¶��£���֪��
��2SO2(g)+O2(g)![]() 2SO3(g) ��H1=-196.6kJ/mol
2SO3(g) ��H1=-196.6kJ/mol
��2NO(g)+O2(g)![]() 2NO2(g)��H2
2NO2(g)��H2
��NO2(g)+SO2(g)![]() SO3(g)+NO(g) ��H3=-41.8kJ/mol
SO3(g)+NO(g) ��H3=-41.8kJ/mol
���H2= _____________��
(2)��Ͷ�ϱ�2:1��SO2��O2���뵽һ�ܱ������з�����Ӧ2SO2(g)+O2(g)![]() 2SO3(g) �����ƽ��ʱSO2��ת�������¶�T��ѹǿp�Ĺ�ϵ��ͼ����ʾ��
2SO3(g) �����ƽ��ʱSO2��ת�������¶�T��ѹǿp�Ĺ�ϵ��ͼ����ʾ��

��A��B�����Ӧ��ƽ�ⳣ����С��ϵΪKA __________���������������=������ͬ��KB���¶�ΪT,ʱD��vD����vD���Ĵ�С��ϵΪvD�� _____________vD����
��T1�¶���ƽ�ⳣ��Kp=______________ kPa-1��KpΪ�Է�ѹ��ʾ��ƽ�ⳣ�����������������ʽ����
(3)���º����£����ڷ�Ӧ2SO2(g)+O2(g)![]() 2SO3(g)�����ƽ��ʱSO3�������������ʼ
2SO3(g)�����ƽ��ʱSO3�������������ʼ![]() �Ĺ�ϵ��ͼ����ʾ����
�Ĺ�ϵ��ͼ����ʾ����![]() =1.5�ﵽƽ��״̬ʱ��SO2�����������ͼ����D��E��F�����е�____________�㡣A��B����SO2ת���ʵĴ�С��ϵΪaA ___���������������=����aB��
=1.5�ﵽƽ��״̬ʱ��SO2�����������ͼ����D��E��F�����е�____________�㡣A��B����SO2ת���ʵĴ�С��ϵΪaA ___���������������=����aB��
(4)��ҵ�������������ɲ��õ绯ѧ�������е�һ�ַ������ڵ��ģʽ��ֱ�ӷ����������е����ֱ���ڵ��Һ�б����ռ��ڵ缫��Ӧ�б�ת���������ڵ��ģʽ��SO2�����ڵ��Һ�У����ڵ缫��Ӧ������Ϊ���ᣬ�ڴ˷�Ӧ�����пɵõ���������Ϊ40%�����ᡣд��ͨ��SO2�缫�ķ�Ӧʽ��____________����40%��������Һ���հ������(NH4)2SO4��ϡ��Һ����ó����£�����Һ��pH=5����![]() ___________������������һλС������֪���¶���NH3��H2O��Kb=1.7��10-5������������Һ������һ����ˮ��ָ����£���
___________������������һλС������֪���¶���NH3��H2O��Kb=1.7��10-5������������Һ������һ����ˮ��ָ����£���![]() ��ֵ��_____���������䡱��С������
��ֵ��_____���������䡱��С������
���𰸡�-113.0kJ��mol��1 �� �� ![]() D �� SO2-2e��+2H2O=SO42��+4H+ 5.9��10-5 ��С
D �� SO2-2e��+2H2O=SO42��+4H+ 5.9��10-5 ��С
��������
��1���ɸ�˹���ɿɵâ�=��-2���ۼ��㣻
��2������Ӱ��ƽ�ⳣ�������ʵ����ؽ�����������ʽ���㣻
��3������Ͷ�϶Է�Ӧ��Ӱ�������
��4������ʧ���ӣ��ٽ����Һ�Ļ�����ɵ缫��Ӧ�����Kw��Kb���м��㡣
(1)�ɸ�˹���ɿɵâ�=��-2���ۣ����ԡ�H2=��H1��2��H3=-196.6kJ��mol��1-2��(-41.8kJ��mol��1)=-113.0kJ��mol��1��
(2)��2SO2(g)+O2(g)![]() 2SO3(g)��Ӧ���ȣ�ѹǿһ��ʱ���¶�Խ�ͣ�SO2��ת����Խ������T1��T2���÷�Ӧ��ƽ�ⳣ��K���¶����߶����ͣ�����KA��KB���¶�ΪT1ʱD��SO2��ת���ʴ���ƽ��ת���ʣ����Է�Ӧ��Ҫ�����ƶ��ﵽƽ�⣬��v����v����
2SO3(g)��Ӧ���ȣ�ѹǿһ��ʱ���¶�Խ�ͣ�SO2��ת����Խ������T1��T2���÷�Ӧ��ƽ�ⳣ��K���¶����߶����ͣ�����KA��KB���¶�ΪT1ʱD��SO2��ת���ʴ���ƽ��ת���ʣ����Է�Ӧ��Ҫ�����ƶ��ﵽƽ�⣬��v����v����
��ѡȡC�����T1�¶��µ�Kpֵ����SO2����ʼ������Ϊ2mol��

SO2%=![]() ��O2%=
��O2%=![]() ��SO3%=
��SO3%=![]() �����ڷ�ѹ=��ѹ�����ʵ�������������Cƽ�������ʵķ�ѹ�ֱ�Ϊp(SO2)=
�����ڷ�ѹ=��ѹ�����ʵ�������������Cƽ�������ʵķ�ѹ�ֱ�Ϊp(SO2)=![]() pc��p(O2)=
pc��p(O2)=![]() pc��P(SO3)=
pc��P(SO3)=![]() pc��Kp=
pc��Kp= kPa-1��
kPa-1��
��3������Ӧ���Ͷ�ϱȵ��ڷ���ʽ��ϵ���ȼ�![]() =2ʱ��SO3��ƽ���������������Ե�Ͷ�ϱ�
=2ʱ��SO3��ƽ���������������Ե�Ͷ�ϱ�![]() =1.5�ﵽƽ��״̬ʱ��SO3�������������Ͷ�ϱ�
=1.5�ﵽƽ��״̬ʱ��SO3�������������Ͷ�ϱ�![]() =1ʱSO3��ƽ����������Ļ����ϼ�����������Ӧ����D�㣬���ڴ�A��Bֻ������SO2����������SO2ת���ʵĴ�СΪaA��aB��
=1ʱSO3��ƽ����������Ļ����ϼ�����������Ӧ����D�㣬���ڴ�A��Bֻ������SO2����������SO2ת���ʵĴ�СΪaA��aB��
(4)��ΪSO2�ڵ���б����������ᣬ����SO2Ӧ�ôӸ���ͨ�룬����ʧ���ӣ��ٽ����Һ�Ļ�����ɵ缫��Ӧ��SO2-2e��+2H2O=SO42-+ =
=![]() 5.9��10-5����(NH4)2SO4��Һ��Ũ��Ϊc��NH4+��ˮ��̶�Ϊa����
5.9��10-5����(NH4)2SO4��Һ��Ũ��Ϊc��NH4+��ˮ��̶�Ϊa����![]() ��������һ����ˮ��ָ����£���ҺŨ������ˮ��̶ȼ�С��(1-a)����ֵ��С��
��������һ����ˮ��ָ����£���ҺŨ������ˮ��̶ȼ�С��(1-a)����ֵ��С��

 ��ʦ������Ԫ��ĩ���100��ϵ�д�
��ʦ������Ԫ��ĩ���100��ϵ�д� ��У������Ԫͬ��ѵ��������ϵ�д�
��У������Ԫͬ��ѵ��������ϵ�д�����Ŀ�������л���Ӧ���͵������жϲ���ȷ����
ѡ�� | �л���Ӧ | ��Ӧ���� |
A | ����H2��Ӧ���ɻ����� | �ӳɷ�Ӧ |
B | ������������Ϲ��ձ�ը | ȡ����Ӧ |
C | ��ϩ�����CCl4��Һ��Ӧ | ȡ����Ӧ |
D | ��ϩʹ���Ը��������Һ��ɫ | ������Ӧ |
A.AB.BC.CD.D
����Ŀ���ϳ�������Ҫ�ɷ���һ����̼�������������ںϳɶ����ѵ����ȼ�ϣ�����Ȼ����úϳ��������п��ܷ����ķ�Ӧ�У�
��CH4(g)+H2O(g)![]() CO(g)+3H2(g) ��H1=+206.1kJ/mol
CO(g)+3H2(g) ��H1=+206.1kJ/mol
��CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) ��H2=+247.3kJ/mol
2CO(g)+2H2(g) ��H2=+247.3kJ/mol
��CO(g)+H2O(g)![]() CO2(g)+H2(g) ��H3=��41.2kJ/mol
CO2(g)+H2(g) ��H3=��41.2kJ/mol
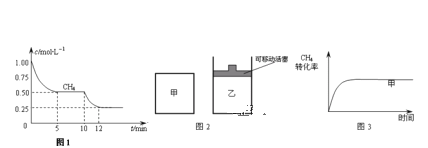
��ش��������⣺
��1����һ�ܱ������н��з�Ӧ�٣����CH4�����ʵ���Ũ���淴Ӧʱ��ı仯��ͼ1��ʾ����Ӧ���е�ǰ5min�ڣ�v (H2)=_____��10minʱ���ı���������������________��
��2����ͼ2��ʾ���ڼס����������зֱ��������ʵ�����CH4��CO2��ʹ�ס�����������ʼ�ݻ���ȣ�����ͬ�¶��·�����Ӧ�ڣ���ά�ַ�Ӧ�������¶Ȳ��䣮��֪��������CH4��ת������ʱ��仯��ͼ����ͼ3��ʾ������ͼ3�л�����������CH4��ת������ʱ��仯��ͼ��_____��
��3��800��ʱ����Ӧ�۵Ļ�ѧƽ�ⳣ��K=1.0��ijʱ�̲�ø��¶��µ��ܱ������и����ʵ����ʵ������±���
CO | H2O | CO2 | H2 |
0.5mol | 8.5mol | 2.0mol | 2.0mol |
��ʱ��Ӧ���������淴Ӧ���ʵĹ�ϵʽ��____________(�����)��
a��v(��)��v (��) b��v(��)��v (��)
c��v(��)= v (��) d�����жϣ�