题目内容
(1)0.5mol SO2,所含有的分子数约为 个,质量为 . 等质量的O2和O3所含的原子个数之比是 . 标准状况下,2mol NH3与 g CO2的体积相等.
(2)已知14g A和40g B恰好完全反应生成0.25mol C和38g D,则C的摩尔质量为
(3)在 mL 0.2mol/L NaOH溶液中含2g溶质;实验室使用的浓盐酸质量分数为36.5%,密度为1.19g/mL,则该浓盐酸的物质的量浓度为 mol/L.
(4)下列物质所含分子数由多到少的排列顺序是.
A.标准状况下33.6L H2
B.所含电子的物质的量为4mol的H2
C.20℃时45g H2O
D.常温下,16g O2与14g N2的混合气体
E.含原子总数约为1.204×1024的NH3.
(2)已知14g A和40g B恰好完全反应生成0.25mol C和38g D,则C的摩尔质量为
(3)在
(4)下列物质所含分子数由多到少的排列顺序是.
A.标准状况下33.6L H2
B.所含电子的物质的量为4mol的H2
C.20℃时45g H2O
D.常温下,16g O2与14g N2的混合气体
E.含原子总数约为1.204×1024的NH3.
考点:物质的量浓度的相关计算,物质分子中的原子个数计算
专题:阿伏加德罗常数和阿伏加德罗定律
分析:(1)根据N=nNA、m=nM计算出0.5mol二氧化硫中含有的分子数、质量;氧气和臭氧中都只有氧原子组成,质量相同的氧气和臭氧中含有相等的原子数;标况下体积相等,则气体的物质的量相等,然后根据m=nM计算出二氧化碳的质量;
(2)根据质量守恒定律计算出C的物质的量,再根据M=
计算出C的摩尔质量;
(3)根据m=nM=cVM计算出需要氢氧化钠溶液的体积;根据c=
计算出该浓盐酸的物质的量浓度;
(4)根据N=nNA可知,物质的量越大,含有的分子数越多,先将各选项中的物理量转化成物质的量,再进行比较物质的量大小即可.
(2)根据质量守恒定律计算出C的物质的量,再根据M=
| m |
| n |
(3)根据m=nM=cVM计算出需要氢氧化钠溶液的体积;根据c=
| 1000ρω |
| M |
(4)根据N=nNA可知,物质的量越大,含有的分子数越多,先将各选项中的物理量转化成物质的量,再进行比较物质的量大小即可.
解答:
解:(1)0.5mol二氧化硫中含有二氧化硫分子的数目为:N=0.5×NA=0.5NA;0.5mol二氧化硫的质量为:m=64g/mol×0.5mol=32g;氧气和臭氧中都只含有氧原子,所以等质量的O2和O3所含的原子个数之比是1:1;标况下,体积相等则气体的物质的量相等,所以二氧化碳的物质的量为2mol,2mol二氧化碳的质量为:44g/mol×2mol=88g,
故答案为:0.5NA或3.01×1023;32g;1:1; 88;
(2)14g A和40g B恰好完全反应生成0.25mol C和38g D,根据质量守恒,生成的C的质量为:14g+40g-38g=16g,则C的摩尔质量为:M(C)=
=64g/mol,
故答案为:64g/mol;
(3)设需要氢氧化钠溶液的体积为VmL,则:m=0.2mol/L×V×10-3L×40g/mol=2g,解得:V=250;
质量分数为36.5%,密度为1.19g/mL的浓盐酸的物质的量浓度为:c=
mol/L=11.9mol/L,
故答案为:250;11.9;
(4)A.标准状况下33.6L氢气的物质的量为:
=1.5mol;
B.氢气分子中含有2个电子,所含电子的物质的量为4mol的氢气的物质的量为2mol;
C.20℃时45g H2O的物质的量为:
=2.5mol;
D.常温下,16g O2与14g N2的混合气体中含有0.5mol氧气和0.5mol氮气,总共含有1mol气体分子;
E.含原子总数约为1.204×1024的NH3,氨气的物质的量为
×
=0.5mol;
根据以上分析可知,各物质的物质的量由大到小的酸性为:CBADE,
故答案为:CBADE.
故答案为:0.5NA或3.01×1023;32g;1:1; 88;
(2)14g A和40g B恰好完全反应生成0.25mol C和38g D,根据质量守恒,生成的C的质量为:14g+40g-38g=16g,则C的摩尔质量为:M(C)=
| 16g |
| 0.25mol |
故答案为:64g/mol;
(3)设需要氢氧化钠溶液的体积为VmL,则:m=0.2mol/L×V×10-3L×40g/mol=2g,解得:V=250;
质量分数为36.5%,密度为1.19g/mL的浓盐酸的物质的量浓度为:c=
| 1000×1.19×36.5% |
| 36.5 |
故答案为:250;11.9;
(4)A.标准状况下33.6L氢气的物质的量为:
| 33.6L |
| 22.4L/mol |
B.氢气分子中含有2个电子,所含电子的物质的量为4mol的氢气的物质的量为2mol;
C.20℃时45g H2O的物质的量为:
| 45g |
| 18g/mol |
D.常温下,16g O2与14g N2的混合气体中含有0.5mol氧气和0.5mol氮气,总共含有1mol气体分子;
E.含原子总数约为1.204×1024的NH3,氨气的物质的量为
| 1 |
| 4 |
| 1.204×1024 |
| 6.02×1023 |
根据以上分析可知,各物质的物质的量由大到小的酸性为:CBADE,
故答案为:CBADE.
点评:本题考查了有关物质的量、物质的量浓度的相关计算,题目难度中等,注意掌握物质的量与摩尔质量、物质的量浓度、阿伏伽德罗常数等物理量之间的关系,明确物质的量浓度的概念及计算方法.

练习册系列答案
相关题目
对于固定体积的密闭容器中进行的气体反应A(g)+B(g)?C(g)+D(g),可以说明在恒温下该反应已达到平衡的是( )
| A、反应容器的压强不随时间而变化 |
| B、A气体和B气体的生成速率相等 |
| C、A气体和C气体的生成速率相等 |
| D、反应混合气体的密度不随时间而变化 |
乙醇分子中各化学键如图所示,对乙醇在各种反应中应断裂的键说明不正确的是( )


| A、和浓H2SO4共热至170℃时,键②和⑤断裂 |
| B、和乙酸共热发生酯化反应时,键②断裂 |
| C、在铜催化下和氧气反应时,键①和③断裂 |
| D、和氢卤酸共热时键②断裂 |
科学家合成了一种新型的氧分子,其化学式为O4.下列关于O4的说法正确的是( )
| A、等质量的O4和O2含有相同数目的原子 |
| B、O4是一种化合物 |
| C、等物质的量的O4和O2,前者所含的分子数多 |
| D、O4的摩尔质量是64g |
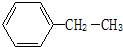
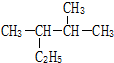
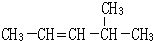
 按要求问答下列问题
按要求问答下列问题