题目内容
12.下列对物质的成分或用途说法,正确的是( )| A. | 二氧化硅是制造太阳能电池的常用材料 | |
| B. | 光导纤维的主要成分是硅 | |
| C. | 用氢氟酸可以蚀刻玻璃 | |
| D. | 石灰石和粘土是制玻璃的主要原料 |
分析 A.二氧化硅为绝缘体;
B.光导纤维的主要成分二氧化硅;
C.二氧化硅能够与氢氟酸反应;
D.根据制造玻璃主要原料来回答.
解答 解:A.硅是良好的半导体材料,是制造太阳能电池的常用材料,故A错误;
B.二氧化硅具有良好的光学特性,是制造光导纤维的主要成分,故B错误;
C.玻璃中含有二氧化硅,能够与氢氟酸反应生成四氟化硅和水,故C正确;
D.生产玻璃的原料有纯碱、石灰石、石英,故D错误;
故选:C.
点评 本题考查了元素化合物知识,侧重考查硅及其化合物性质及用途,题目难度不大,掌握基础是关键.

练习册系列答案
相关题目
2.(2015•江苏镇江高三期末•15)900℃时,向2.0L恒容密闭容器中充入0.40mol乙苯,发生反应:
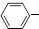 C2H5(g)?
C2H5(g)?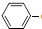 CH=CH2(g)+H2(g)△H=akJ.mol-1.经一段时间后达到平衡.反应过程中测定的部分数据见下表:
CH=CH2(g)+H2(g)△H=akJ.mol-1.经一段时间后达到平衡.反应过程中测定的部分数据见下表:
下列说法正确的是( )
 C2H5(g)?
C2H5(g)? CH=CH2(g)+H2(g)△H=akJ.mol-1.经一段时间后达到平衡.反应过程中测定的部分数据见下表:
CH=CH2(g)+H2(g)△H=akJ.mol-1.经一段时间后达到平衡.反应过程中测定的部分数据见下表:| 时间/min | 0 | 10 | 20 | 30 | 40 |
| n(乙苯)/mol | 0.40 | 0.30 | 0.24 | n2 | n3 |
| n(苯乙烯)/mol | 0.00 | 0.10 | n1 | 0.20 | 0.20 |
| A. | 反应在前20 min的平均速率为v(H2)=0.004mol•L-1•min-1 | |
| B. | 保持其他条件不变,升高温度,平衡时,c(乙苯)=0.08mol•L-1,则a<0 | |
| C. | 保持其他条件不变,向容器中充入不参与反应的水蒸气作为稀释剂,则乙苯的转化率为50.0% | |
| D. | 相同温度下,起始时向容器中充入0.10mol乙苯、0.10mol苯乙烯和0.30molH2,达到平衡前v(正)>v(逆) |
3.常温下,下列各组微粒在指定的溶液中一定大量存在都是( )
| A. | NaAlO2溶液中:Cl-、HCO3-、K+、Ba2+ | |
| B. | FeCl3溶液中:K+、NH4+、Br-、SCN- | |
| C. | $\frac{c{(H}^{+})}{c(O{H}^{-})}$=1012的溶液中:NH4+、NO3-、K+、Cl- | |
| D. | KMnO4的溶液中:H+、SO42-、CH3CH2OH |
20.向100ml碘化亚铁溶液中缓慢通入标况下4.48L氯气,完全反应后,溶液中有一半的Fe2+未被氧化,则原碘化亚铁溶液的物质的量浓度是( )
| A. | 1.2mol/L | B. | 1.5mol/L | C. | 1.6mol/L | D. | 2.0mol/L |
7.生活处处有化学.下列说法正确的是( )
| A. | 糖类化合物都具有相同的官能团 | |
| B. | 煎炸食物的花生油和牛油都是可皂化的酯类 | |
| C. | 做衣服的棉和麻均与淀粉互为同分异构体 | |
| D. | 磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 |
17.除去下列各种物质中的少量杂质,正确的是( )
| 选项 | 各种物质中的少量杂质 | 试剂 | 方法 |
| A | 苯中的溴 | NaOH溶液 | 分液 |
| B | 乙醇中的乙酸 | 浓硫酸 | 加热 |
| C | 乙酸乙酯中的乙酸 | NaOH溶液 | 分液 |
| D | 甲烷中混有乙烯 | 酸性KMnO4溶液 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
4.短周期元素A、M、X、Y、Z、E的原子序数依次增大,其元素特征信息如下表
(1)M与X形成的化合物X2M2中含有的化学键为离子键、共价键;X、Y的最高价氧化物对应的水化物之间发生反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.(用元素符号表示,下同)
(2)Y E3的水溶液显酸性,用离子方程式解释原因Al3++3H2O?Al(OH)3+3H+;Z的低价氧化物和E单质同时通入水中发生反应的离子方程式为SO2+Cl2+2H2O=4H++SO42-+2Cl-.
(3)请用“>”、“=”或“<”对物质性质进行比较
(4)X、Y、Z、E四种元素简单离子的离子半径由小到大的顺序是r (Al3+)<r (Na+)<r (Cl-)<r (S2-).
(5)E的最高价氧化物为无色液体,0.25mol该物质与一定量水混合得到一种稀溶液,并放出Q kJ的热量.写出该反应的热化学方程式Cl2O7(l)+H2O(l)=2HClO4(aq)△H=-4QkJ/mol.
| 元素编号 | 元素特征信息 |
| A | 单质是密度最小的气体 |
| M | 其单质为生命活动不可缺少的气体 |
| X | 短周期中原子半径最大的元素 |
| Y | 地壳中含量最高的金属元素 |
| Z | 最外层电子数是最内层电子数的3倍 |
| E | 单质为黄绿色气体 |
(2)Y E3的水溶液显酸性,用离子方程式解释原因Al3++3H2O?Al(OH)3+3H+;Z的低价氧化物和E单质同时通入水中发生反应的离子方程式为SO2+Cl2+2H2O=4H++SO42-+2Cl-.
(3)请用“>”、“=”或“<”对物质性质进行比较
| 沸点 | 气态氢化物稳定性 | 最高价氧化物 对应水化物的碱性 | 得电子能力 |
| A2M>A2Z | Z< E | X> Y | 16M= 18M |
(5)E的最高价氧化物为无色液体,0.25mol该物质与一定量水混合得到一种稀溶液,并放出Q kJ的热量.写出该反应的热化学方程式Cl2O7(l)+H2O(l)=2HClO4(aq)△H=-4QkJ/mol.
1. 把下列物质分别加入盛水的锥形瓶内,立即塞紧带U形管的塞子.已知U形管内预先装有少量水且液面相平(为便于观察,预先染成红色),加入下列哪些物质后,发生如图所示变化( )
把下列物质分别加入盛水的锥形瓶内,立即塞紧带U形管的塞子.已知U形管内预先装有少量水且液面相平(为便于观察,预先染成红色),加入下列哪些物质后,发生如图所示变化( )
①NaOH粉末;②18mol/L的H2SO4溶液; ③NH4NO3晶体;④Na2O2固体;⑤生石灰.
 把下列物质分别加入盛水的锥形瓶内,立即塞紧带U形管的塞子.已知U形管内预先装有少量水且液面相平(为便于观察,预先染成红色),加入下列哪些物质后,发生如图所示变化( )
把下列物质分别加入盛水的锥形瓶内,立即塞紧带U形管的塞子.已知U形管内预先装有少量水且液面相平(为便于观察,预先染成红色),加入下列哪些物质后,发生如图所示变化( )①NaOH粉末;②18mol/L的H2SO4溶液; ③NH4NO3晶体;④Na2O2固体;⑤生石灰.
| A. | ①②④⑤ | B. | ①②③ | C. | ②③⑤ | D. | ③④⑤ |
2.下列现象或应用不能用胶体的知识解释的是( )
| A. | 可吸入颗粒(如硅酸盐粉尘),吸入人体,对人体健康危害极大 | |
| B. | 土壤表面积巨大且一般带负电,能吸收NH4+等营养离子,使土壤具有保肥能力 | |
| C. | 水泥、冶金工厂常用高压电除去工厂烟尘,减少对空气的污染 | |
| D. | 氯化铝溶液中加入碳酸钠溶液会出现白色沉淀 |