题目内容
2.下列有关物质的性质与其应用不相对应的是( )| A. | Al具有良好延展性和抗腐蚀性,可制成铝箔包装物品 | |
| B. | NH3 能与Cl2 生成NH4Cl,可用浓氨水检验输送氯气的管道是否有泄漏 | |
| C. | NaHCO3 能与碱反应,食品工业用作焙制糕点的膨松剂 | |
| D. | K2FeO4 能与水作用生成Fe(OH)3 胶体和O2,可用于净化自来水并杀菌消毒 |
分析 A.铝能制成铝箔是因为铝具有良好的延展性和防腐性;
B.浓氨水被氯气氧化为氮气和氯化氢,氯化氢和氨气生成白色烟;
C.食品工业用作焙制糕点的膨松剂,利用碳酸氢钠和酸反应生成二氧化碳气体;
D.氢氧化铁胶体具有吸附作用吸附悬浮杂质,K2FeO4是强氧化剂杀菌消毒.
解答 解:A.铝能制成铝箔是因为铝具有良好的延展性和防腐性,铝表面氧化铝性质稳定,可制成铝箔包装物品,故A正确;
B.用浓氨水检验输送氯气的管道是否有泄漏,若浓氨水靠近处出现白色烟说明漏气,故B正确;
C.食品工业用作焙制糕点的膨松剂,利用碳酸氢钠和酸反应生成二氧化碳气体,不是利用NaHCO3能与碱反应的性质,故C错误;
D.氢氧化铁胶体具有吸附作用吸附悬浮杂质,K2FeO4是强氧化剂杀菌消毒,可用于自来水的净化和杀菌消毒,故D正确.
故选C.
点评 本题考查学生关注化学与工农业生产、日常生活、社会热点问题,涉及铝、碳酸氢钠、浓氨水、氢氧化铁等物质性质的应用和用途,为高考常见题型,有利于培养学生良好的科学素养,提高学习的积极性,注意相关基础知识的积累,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
14. 中国女药学家屠呦呦因成功提取青离素而获得2015年诺贝尔医学奖,有关青蒿素的结构如图所示,下列关于靑蒿素的推断,不合理的是( )
中国女药学家屠呦呦因成功提取青离素而获得2015年诺贝尔医学奖,有关青蒿素的结构如图所示,下列关于靑蒿素的推断,不合理的是( )
 中国女药学家屠呦呦因成功提取青离素而获得2015年诺贝尔医学奖,有关青蒿素的结构如图所示,下列关于靑蒿素的推断,不合理的是( )
中国女药学家屠呦呦因成功提取青离素而获得2015年诺贝尔医学奖,有关青蒿素的结构如图所示,下列关于靑蒿素的推断,不合理的是( )| A. | 青蒿素的分子式是C15H22O5 | B. | 青蒿素在碱性条件下不能稳定存在 | ||
| C. | 青蒿素所有碳原子均在同一平面上 | D. | 青蒿素可以发生氧化反应 |
11.下列根据实验现象得出的结论正确的是( )
| 实验 | 现象 | 结论 | |
| A | 将饱和食盐水滴入工业电石得到的气体通入酸性KMnO4溶液中 | KMnO4溶液紫红色褪去 | 证明生成了乙炔气体 |
| B | 将BaSO4与浓Na2CO3溶液混合后振荡静置,过滤并洗净所得的沉淀,往滴加足量盐酸 | 产生使澄清石灰水变浑浊的气体 | Ksp(BaCO3)<Ksp(BaSO4) |
| C | 充分加热花生油与NaOH混合溶液(已加沸石) | 溶液不再分层 | 花生油的水解反应已经趋于完全 |
| D | 向含KSCN的FeI2溶液中滴加足量氯水 | 溶液变为血红色 | 还原性:Fe2+>I- |
| A. | A | B. | B | C. | C | D. | D |
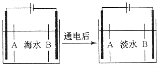 南海诸岛是我国固有领土,但多数岛上淡水资源匮乏,为检验某岛上泉水是否达标,取样品对其进行检验:
南海诸岛是我国固有领土,但多数岛上淡水资源匮乏,为检验某岛上泉水是否达标,取样品对其进行检验: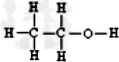 .
.
 $→_{△}^{KMnO_{4}/H+}$
$→_{△}^{KMnO_{4}/H+}$

 +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$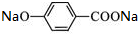 +
+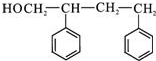 +H2O.
+H2O. (写出其中一种的结构简式).
(写出其中一种的结构简式).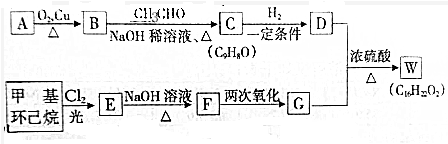
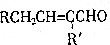 +H2O(R、R′为H或烃基)
+H2O(R、R′为H或烃基) ;C中含有的官能团为碳碳双键、醛基(写名称).
;C中含有的官能团为碳碳双键、醛基(写名称). .
.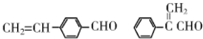 .
.
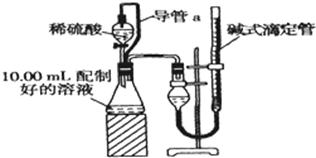 实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数W(Na2CO3),称取此混合物5.0g,溶于水中,配成250mL溶液.
实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数W(Na2CO3),称取此混合物5.0g,溶于水中,配成250mL溶液. ,其中氮的化合价为-2.
,其中氮的化合价为-2.