题目内容
7.C 和Si元素在化学中占有极其重要的地位.(1)写出Si的基态原子核外电子排布式1s22s22p63s23p2.
(2)SiC的晶体结构与晶体硅的相似,其中C原子的杂化方式为sp3,微粒间存在的作用力是共价键.
(3)氧化物MO的电子总数与SiC的相等,则M为Mg(填元素符号),MO是优良的耐高温材料,其晶体结构与NaCl晶体相似,MO的熔点比CaO的高,其原因是Mg 2+半径比Ca 2+小,MgO的晶格能大.
分析 (1)Si的原子核外有14个电子分三层排布;
(2)SiC中每个C原子形成4个共价键,价层电子对数为4;非金属原子之间形成的化学键为共价键;
(3)根据电子数相等计算M原子电子数,根据原子中电子数=原子序数确定元素;根据离子晶体的熔点与晶格能成正比,晶格能与离子半径成反比;
解答 解:(1)Si的原子核外有14个电子分三层排布,则其电子排布式为1s22s22p63s23p2;
故答案为:1s22s22p63s23p2;
(3)SiC中每个C原子形成4个共价键,价层电子对数为4,则C原子的杂化方式为sp3;SiC中C原子与Si原子之间以共价键结合;
故答案为:sp3;共价键;
(3)氧化物MO的电子总数与SiC的相等,则M原子中电子数为12,原子中电子数=原子序数=12,所以M为Mg元素;MgO和CaO都是离子晶体,镁离子半径小于钙离子,且二者所带电荷相等,所以MgO的晶格能大于CaO,所以MgO的熔点高于CaO;
故答案为:Mg;Mg 2+半径比Ca 2+小,MgO的晶格能大;
点评 本题考查较综合,涉及原子杂化方式的判断、晶格能等知识点,根据存在的σ键个数确定原子杂化方式,根据离子晶体熔点与晶格能、离子半径的关系来分析解答,题目难度不大.

练习册系列答案
 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案
相关题目
12.在密闭容器中A与B反应生成C,其反应速率分别用vA、vB、vC表示,已知3vB=2vA、2vC=3vB,则此反应可表示为( )
| A. | 2A+3B=2C | B. | A+3B=2C | C. | 3A+B=2C | D. | 3A+2B=3C |
18.利用下列装置(部分仪器已省略),能顺利完成对应实验的是( )
| A. |  向容量瓶中转移 向容量瓶中转移 | B. |  碳酸氢钠受热分解 碳酸氢钠受热分解 | ||
| C. |  制氢氧化亚铁 制氢氧化亚铁 | D. |  分离花生油和水 分离花生油和水 |
15.下列分子表示的物质一定是纯净物的是( )
| A. | C5H10 | B. | C2H4O2 | C. | C2H5Cl | D. | C2H4Cl2 |
12.用NA表示阿伏加德罗常数的值.下列叙述不正确的是( )
| A. | 标准状况下,33.6L氯气与56g铁充分反应,转移电子数为3NA | |
| B. | 常温常压下,22.4L丙烷中共价键数目为10NA | |
| C. | 通常状况下,2.24LNO2和N2O4的混合气体中氮原子和氧原子数比为1:2 | |
| D. | 1mol L-1的Na2CO3溶液中所含阴离子数大于NA个 |
19.下列有机物命名正确的选项为( )
| A. | 3,3-甲基丁烷 | B. | 2,2-二甲基戊烷 | ||
| C. | 2-甲基乙烷 | D. | 2,3,3-三甲基丁烷 |
17.下列关于钠的叙述中,正确的是( )
| A. | 钠是银白色金属,熔点低,硬度大 | |
| B. | 钠放置于空气中,会迅速被氧化而生成淡黄色的氧化钠 | |
| C. | 在氧气中加热时,金属钠剧烈燃烧,黄色火焰 | |
| D. | 金属钠着火可以用水灭火 |
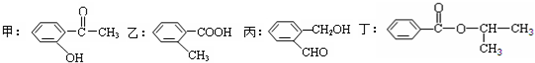
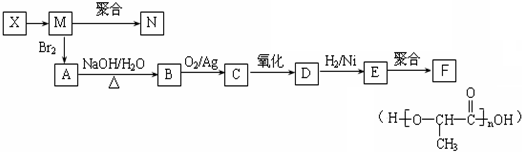
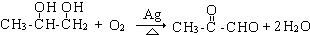 .
. .
.