题目内容
(1)37Cl-离子结构示意图 ,质量相等的两种物质SO2和SO3,所含氧原子个数之为 ;
(2)20.6g NaR 含有Na+0.2mol,则NaR的摩尔质量为 ,则含R 8.0g 的NaR的物质的量为 ;
(3)在标准状况下,4.8g甲烷(CH4)所占的体积为 L,它与标准状况下 L硫化氢(H2S)含有相同数目的氢原子;
(4)在100g浓度为18mol?L-1、密度为ρ(g?cm-3)的浓硫酸中加入一定量的水稀释成9mol?L-1的硫酸,则加入水的体积 100mL(填“>”、“<”、“=”)
(2)20.6g NaR 含有Na+0.2mol,则NaR的摩尔质量为
(3)在标准状况下,4.8g甲烷(CH4)所占的体积为
(4)在100g浓度为18mol?L-1、密度为ρ(g?cm-3)的浓硫酸中加入一定量的水稀释成9mol?L-1的硫酸,则加入水的体积
考点:物质的量的相关计算,原子结构示意图
专题:计算题
分析:(1)氯离子核电荷数为17,核外电子总数为18,据此画出氯离子结构示意图;质量相等,物质的量与摩尔质量成反比,据此计算出含有的氧原子个数之比;
(2)根据M=
计算出NaR的摩尔质量;再根据n=
计算出NaR的物质的量;
(3)先计算出甲烷的物质的量,再根据标况下的气体摩尔体积计算出甲烷的体积;
(4)18mol?L-1的浓硫酸变为9mol/L,溶液体积需要扩大为原来的2倍,根据浓硫酸密度大于水的密度进行判断.
(2)根据M=
| m |
| n |
| m |
| M |
(3)先计算出甲烷的物质的量,再根据标况下的气体摩尔体积计算出甲烷的体积;
(4)18mol?L-1的浓硫酸变为9mol/L,溶液体积需要扩大为原来的2倍,根据浓硫酸密度大于水的密度进行判断.
解答:
(1)氯离子是有氯原子得到1个电子形成的,核电荷数为17,核外电子数为18,则氯离子的结构示意图为: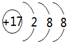 ;
;
质量相等的SO2和SO3的物质的量之比与其摩尔质量成反比,二者物质的量之比为:80g/mol:64g/mol=5:4,所含氧原子个数之为:5×2:4×3=5:6,
故答案为: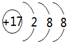 ;5:6;
;5:6;
(2)20.6g NaR 含有Na+0.2mol,则NaR的物质的量为0.2mol,则NaR的摩尔质量为:
=103g/mol;
R的相对原子量为:103-23=80,8.0gR的物质的量为0.1mol,则含R 8.0g 的NaR的物质的量为0.1mol,
故答案为:103 g/mol; 0.1mol;
(3)4.8g甲烷的物质的量为:
=0.3mol,标况下0.3mol甲烷的所占体积约为:22.4L/mol×0.3mol=6.72L;0.3mol甲烷中含有含有氢原子的物质的量为0.3mol×4=1.2mol,需要硫化氢的物质的量为:
=0.6mol,标况下0.6mol硫化氢的我知道为:22.4L/mol×0.6mol=13.44L,
故答案为:6.72;13.44;
(4)浓硫酸浓度要缩小一半,则溶液体积需要扩大1倍,水的密度约为1g/mol,100g浓硫酸的体积一定小于100mL,所以加入水的体积应该小于100mL,
故答案为:<.
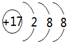 ;
;质量相等的SO2和SO3的物质的量之比与其摩尔质量成反比,二者物质的量之比为:80g/mol:64g/mol=5:4,所含氧原子个数之为:5×2:4×3=5:6,
故答案为:
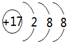 ;5:6;
;5:6; (2)20.6g NaR 含有Na+0.2mol,则NaR的物质的量为0.2mol,则NaR的摩尔质量为:
| 20.6g |
| 0.2mol |
R的相对原子量为:103-23=80,8.0gR的物质的量为0.1mol,则含R 8.0g 的NaR的物质的量为0.1mol,
故答案为:103 g/mol; 0.1mol;
(3)4.8g甲烷的物质的量为:
| 4.8g |
| 16g/mol |
| 1.2mol |
| 2 |
故答案为:6.72;13.44;
(4)浓硫酸浓度要缩小一半,则溶液体积需要扩大1倍,水的密度约为1g/mol,100g浓硫酸的体积一定小于100mL,所以加入水的体积应该小于100mL,
故答案为:<.
点评:本题考查了有关物质的量的计算、原子结构示意图的书写,题目难度中等,注意掌握物质的量与摩尔质量、气体摩尔体积之间的转化关系,明确原子结构示意图的概念及表示方法.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
将23克金属钠放入足量mg水中,再将24克金属镁放入足量m克稀盐酸中.反应后所得溶液的质量分别为a克和b克.那么,a和b两数值的关系应是( )
| A、a>b | B、a<b |
| C、a=b | D、无法确定 |
下列各组物质,前者不能制出后者的是( )
| A、C和Si |
| B、Cu和Fe |
| C、SiO2和CO2 |
| D、Cl2和HCl |

 已知某温度下CH3COOH的电离常数K=1.6×10-5.该温度下向20mL 0.01mol?L-1CH3COOH溶液中逐滴加入0.01mol?L-1KOH溶液,其pH变化曲线如图所示(忽略温度变化).请回答下列有关问题:
已知某温度下CH3COOH的电离常数K=1.6×10-5.该温度下向20mL 0.01mol?L-1CH3COOH溶液中逐滴加入0.01mol?L-1KOH溶液,其pH变化曲线如图所示(忽略温度变化).请回答下列有关问题: