题目内容
前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A、B属于同一短周期元素且相邻,A元素所形成的化合物种类最多,C、D、E、F是位于同一周期的金属元素,基态C、F原子的价电子层中未成对电子均为1个,且C、F原子的电子数相差为10,基态D、E原子的价电子层中未成对电子数分别为4、2,且原子序数相差为2.
(1)六种元素中第一电离能最小的是 (填元素符号,下同),电负性最大的是 .
(2)黄血盐是由A、B、C、D四种元素形成的配位化合物C4[D(AB)6],易溶于水,广泛用作食盐添加剂(抗结剂).请写出黄血盐的化学式 ,1mol AB-中含有π键的数目为 ,黄血盐晶体中各种微粒间的作用力不涉及 (填序号).
a.离子键 b.共价键 c.配位键 d.金属键 e.氢键 f.分子间的作用力
(3)E2+的价层电子排布图为 ,很多不饱和有机物在E催化下可与H2发生加成反应:如①CH2=CH2、②HC≡CH、③ 、④HCHO.其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子的立体结构为 形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质) .
、④HCHO.其中碳原子采取sp2杂化的分子有 (填物质序号),HCHO分子的立体结构为 形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质) .
(4)金属C、F晶体的晶胞结构如图(请先判断对应的图),C、F两种晶体晶胞中金属原子的配位数之比为 .金属C的晶胞中,若设该晶胞的密度为a g/cm3,阿伏加得罗常数为NA,C原子的摩尔质量为M,则表示C原子半径的计算式为 .

(1)六种元素中第一电离能最小的是
(2)黄血盐是由A、B、C、D四种元素形成的配位化合物C4[D(AB)6],易溶于水,广泛用作食盐添加剂(抗结剂).请写出黄血盐的化学式
a.离子键 b.共价键 c.配位键 d.金属键 e.氢键 f.分子间的作用力
(3)E2+的价层电子排布图为
 、④HCHO.其中碳原子采取sp2杂化的分子有
、④HCHO.其中碳原子采取sp2杂化的分子有(4)金属C、F晶体的晶胞结构如图(请先判断对应的图),C、F两种晶体晶胞中金属原子的配位数之比为

考点:位置结构性质的相互关系应用,晶胞的计算
专题:元素周期律与元素周期表专题,化学键与晶体结构
分析:前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A、B属于同一短周期元素且相邻,A元素所形成的化合物种类最多,则A为碳元素、B为N元素;C、D、E、F是位于同一周期的金属元素,只能处于第四周期,基态C、F原子的价电子层中未成对电子均为1个,且C、F原子的电子数相差为10,可推知C为K、F为Cu,基态D、E原子的价电子层中未成对电子数分别为4、2,且原子序数相差为2,D、E价电子排布分别为3d64s2,3d84s2,故D为Fe、E为Ni,据此解答.
解答:
解:前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A、B属于同一短周期元素且相邻,A元素所形成的化合物种类最多,则A为碳元素、B为N元素;C、D、E、F是位于同一周期的金属元素,只能处于第四周期,基态C、F原子的价电子层中未成对电子均为1个,且C、F原子的电子数相差为10,可推知C为K、F为Cu,基态D、E原子的价电子层中未成对电子数分别为4、2,且原子序数相差为2,D、E价电子排布分别为3d64s2,3d84s2,故D为Fe、E为Ni,
(1)六种元素中K的金属性最强,其第一电离能最小,非金属性越强电负性越大,故电负性最大的是N,
故答案为:K;N;
(2)黄血盐的化学式K4[Fe(CN)6],CN-与氮气互为等电子体,CN-中存在C≡N三键,故1mol CN-中含有π键的数目为2NA,黄血盐晶体中含有离子键、配位键、共价键,没有金属键、氢键、分子间的作用力,
故答案为:K4[Fe(CN)6];2NA;def;
(3)Ni2+的价层电子排布式为3d8,故价电子排布图为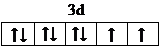 ;
;
①CH2=CH2、③ 、④HCHO中C原子价层电子对数都是3,没有孤电子对,C原子采取sp2杂化,②HC≡CH为C原子价层电子对数是2,没有孤电子对,C原子采取sp杂化,HCHO分子的立体结构为 平面三角形,它加成产物为甲醇,甲醇分子之间形成氢键,其熔、沸点比CH4的熔、沸点高,
、④HCHO中C原子价层电子对数都是3,没有孤电子对,C原子采取sp2杂化,②HC≡CH为C原子价层电子对数是2,没有孤电子对,C原子采取sp杂化,HCHO分子的立体结构为 平面三角形,它加成产物为甲醇,甲醇分子之间形成氢键,其熔、沸点比CH4的熔、沸点高,
故答案为: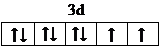 ;①③④;平面三角;加成产物CH3OH分子之间能形成氢键;
;①③④;平面三角;加成产物CH3OH分子之间能形成氢键;
(4)金属K晶体为体心立方堆积,晶胞结构为图Ⅰ,晶胞中K原子配位数为8,金属Cu晶体为面心立方最密堆积,晶胞结构为图Ⅱ,以顶点Cu原子研究与之最近的原子位于面心,每个顶点Cu原子为12个面共用,晶胞中Cu原子配位数为12,K、Cu两种晶体晶胞中金属原子的配位数之比为 8:12=2:3;
金属K的晶胞中,K原子数目=1+8×
=2,若K原子的摩尔质量为M,阿伏加得罗常数为NA,则晶胞质量=
g,设该晶胞的密度为a g/cm3,则晶胞体积=
=
cm3,晶胞棱长=
cm,设K原子半径为r,则晶胞体对角线长度=4r,故3(
cm)2=(4r)2,故r=
×
cm,
故答案为:2:3;
×
cm.
(1)六种元素中K的金属性最强,其第一电离能最小,非金属性越强电负性越大,故电负性最大的是N,
故答案为:K;N;
(2)黄血盐的化学式K4[Fe(CN)6],CN-与氮气互为等电子体,CN-中存在C≡N三键,故1mol CN-中含有π键的数目为2NA,黄血盐晶体中含有离子键、配位键、共价键,没有金属键、氢键、分子间的作用力,
故答案为:K4[Fe(CN)6];2NA;def;
(3)Ni2+的价层电子排布式为3d8,故价电子排布图为
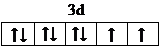 ;
;①CH2=CH2、③
 、④HCHO中C原子价层电子对数都是3,没有孤电子对,C原子采取sp2杂化,②HC≡CH为C原子价层电子对数是2,没有孤电子对,C原子采取sp杂化,HCHO分子的立体结构为 平面三角形,它加成产物为甲醇,甲醇分子之间形成氢键,其熔、沸点比CH4的熔、沸点高,
、④HCHO中C原子价层电子对数都是3,没有孤电子对,C原子采取sp2杂化,②HC≡CH为C原子价层电子对数是2,没有孤电子对,C原子采取sp杂化,HCHO分子的立体结构为 平面三角形,它加成产物为甲醇,甲醇分子之间形成氢键,其熔、沸点比CH4的熔、沸点高,故答案为:
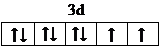 ;①③④;平面三角;加成产物CH3OH分子之间能形成氢键;
;①③④;平面三角;加成产物CH3OH分子之间能形成氢键;(4)金属K晶体为体心立方堆积,晶胞结构为图Ⅰ,晶胞中K原子配位数为8,金属Cu晶体为面心立方最密堆积,晶胞结构为图Ⅱ,以顶点Cu原子研究与之最近的原子位于面心,每个顶点Cu原子为12个面共用,晶胞中Cu原子配位数为12,K、Cu两种晶体晶胞中金属原子的配位数之比为 8:12=2:3;
金属K的晶胞中,K原子数目=1+8×
| 1 |
| 8 |
| 2×M |
| NA |
| ||
| a g/cm3 |
| 2M |
| aNA |
| 3 |
| ||
| 3 |
| ||
| ||
| 4 |
| 3 |
| ||
故答案为:2:3;
| ||
| 4 |
| 3 |
| ||
点评:本题是对物质结构的考查,涉及元素推断、核外电子排布、电离能、电负性、配合物、化学键、杂化轨道、晶胞计算等,较好的考查物质结构的主干知识,(4)为易错点、难点,需要学生熟记晶胞结构,对学生的空间想象及数学计算具有一定的要求,难点中等.

练习册系列答案
 小学课时特训系列答案
小学课时特训系列答案
相关题目
下列反应离子方程式正确的是( )
| A、过量石灰水与碳酸氢钙反应:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O |
| B、FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+═4Fe3++2H2O |
| C、向氯化铝溶液中滴加过量氨水:Al3++4NH3?H2O═AlO42-+4NH4++2H2O |
| D、H2SO4与Ba(OH)2溶液反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O |
下列各组物质不能实现直接转化的是( )
| A、S→SO2→H2SO4→MgSO4 |
| B、Cu→CuCl2→Cu(NO3)2→Cu(OH)2 |
| C、Al→Al2O3→Al(OH)3→NaAlO2 |
| D、Na→Na2O→Na2CO3→NaCl |
下列说法不正确的是( )
| A、纤维素和乙酸酐作用可生成纤维素三乙酸酯和乙酸 |
B、环戊二烯( )分子中所有碳原子共平面 )分子中所有碳原子共平面 |
C、七叶内酯( )和东莨菪内酯( )和东莨菪内酯( )都是某些中草药的成分,它们具有相同的官能团,互为同系物 )都是某些中草药的成分,它们具有相同的官能团,互为同系物 |
D、 该有机物属于单糖,在一定条件下能发生取代、消去、加成、氧化、还原等反应 该有机物属于单糖,在一定条件下能发生取代、消去、加成、氧化、还原等反应 |
氨氧化制硝酸的反应如下:①NH3+O2→NO+H2O;②NO+O2→NO2;③NO2+H2O→HNO3+NO.如将氨全部氧化得2mol硝酸,下列哪个值是理论上需氧气的物质的量是( )
| A、2 mol |
| B、3 mol |
| C、4 mol |
| D、5 mol |
 (1)电子表中的电源常用微型银锌原电池,其电极分别为Ag2O和Zn,电解质溶液为KOH溶液,总反应式为:Ag2O+H2O+Zn═Zn(OH)2+2Ag.请回答:放电时氧化银电极上的反应式为:
(1)电子表中的电源常用微型银锌原电池,其电极分别为Ag2O和Zn,电解质溶液为KOH溶液,总反应式为:Ag2O+H2O+Zn═Zn(OH)2+2Ag.请回答:放电时氧化银电极上的反应式为: