题目内容
食盐是人类生活中不可缺少的物质,海水中含有大量食盐.某地出产的粗盐中,所含杂质是CaCl2,通过下面的实验可制得纯净的NaCl.

请回答:
(1)加入的A是 ,检验A已过量的方法是
(2)加入的B是 ,加入稍过量B的目的是
(3)为检验沉淀是否洗净,最好在最后几滴洗出液中加入 溶液.

请回答:
(1)加入的A是
(2)加入的B是
(3)为检验沉淀是否洗净,最好在最后几滴洗出液中加入
考点:粗盐提纯
专题:
分析:根据粗盐中,所含杂质是CaCl2,故应加入的除杂试剂A为过量的Na2CO3,过滤,所得沉淀为CaCO3,所得滤液中含Na+、Cl-和过量的CO32-,故应加入过量的HCl除去CO32-,由于盐酸易挥发,故蒸发结晶即可得纯净的NaCl.据此分析.
解答:
解:根据粗盐中,所含杂质是CaCl2,故应加入的除杂试剂A为过量的Na2CO3,过滤,所得沉淀为CaCO3,所得滤液中含Na+、Cl-和过量的CO32-,故应加入过量的HCl除去CO32-,由于盐酸易挥发,故蒸发结晶即可得纯净的NaCl.据此分析.
(1)加入的A是Na2CO3,检验A已过量即检验溶液中是否有过量的CO32-,方法是取上层清液于试管中,然后向试管中滴加稀盐酸,如果有气泡产生,则说明Na2CO3已过量,故答案为:Na2CO3;取上层清液于试管中,然后向试管中滴加稀盐酸,如果有气泡产生,则说明Na2CO3已过量;
(2)加入的B为HCl,目的是为了除去前面过量的CO32-,故答案为:HCl,除去溶液中过量的CO32-;
(3)由于沉淀CaCO3是从NaCl溶液中过滤出来的,故沉淀上有Cl-和Na+残留,检查CaCO3是否洗净即检查洗涤液中是否有Cl-,即向最后一次洗涤液中加入硝酸酸化的AgNO3溶液,故答案为:硝酸酸化的AgNO3溶液.
(1)加入的A是Na2CO3,检验A已过量即检验溶液中是否有过量的CO32-,方法是取上层清液于试管中,然后向试管中滴加稀盐酸,如果有气泡产生,则说明Na2CO3已过量,故答案为:Na2CO3;取上层清液于试管中,然后向试管中滴加稀盐酸,如果有气泡产生,则说明Na2CO3已过量;
(2)加入的B为HCl,目的是为了除去前面过量的CO32-,故答案为:HCl,除去溶液中过量的CO32-;
(3)由于沉淀CaCO3是从NaCl溶液中过滤出来的,故沉淀上有Cl-和Na+残留,检查CaCO3是否洗净即检查洗涤液中是否有Cl-,即向最后一次洗涤液中加入硝酸酸化的AgNO3溶液,故答案为:硝酸酸化的AgNO3溶液.
点评:本题考查了粗盐的提纯,应注意的是除杂试剂的选择和杂质离子的检验,难度不大.

练习册系列答案
相关题目
某有机物6g与足量Na反应,生成0.05mol H2,该有机物可能是( )
| A、CH3CH2OH |
B、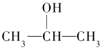 |
| C、CH3OH |
| D、CH3CH2COOH |
将一定量有机物充分燃烧后的产物通入足量石灰水中完全吸收,经过滤得到沉淀20g,滤液质量比原石灰水减少5.8g.等物质的量的此有机物与足量金属Na反应在标准状况下产生2.24L气体,则此有机物为( )
| A、乙烯 |
B、乙二醇( ) ) |
| C、乙醇 |
| D、乙酸 |
常温常压下,某容器真空时质量为116g 当它盛满N2时质量为123 g而盛满某气体Y时质量为120g则Y气体可能是( )
| A、O2 |
| B、CH4 |
| C、C3H8 |
| D、CO |
常温下,向20L真空容器中通入a mol H2S和b mol Cl2 (a、b都是正整数,且a≤5,b≤5),反应完毕后,容器内气体可能达到的最大密度是( )
| A、26.25 g?L-1 |
| B、18.25 g?L-1 |
| C、17.85 g?L-1 |
| D、12.05 g?L-1 |
下列各组物质中,互为同分异构体的是( )
| A、白磷和红磷 |
| B、CH3CH2CH3和CH3CH2CH2CH3 |
| C、CH3CH(CH3)CH2CH3和CH3CH2CH(CH3)CH3 |
| D、CH3CH(CH3)CH2CH3和CH3CH2CH2CH2CH3 |