题目内容
(1)相同质量的Na、Mg、Al与过量的盐酸反应,在相同状况下,三者置换出的H2的体积比是 ;
(2)相同物质的量的Na、Mg、Al与过量的盐酸反应,在相同状况下,三者置换出的H2的体积之比是
(3)Na、Mg、Al与过量的盐酸反应,在相同状况下产生的氢气的体积相等,则Na、Mg、Al三种金属的物质的量之比是 .
(2)相同物质的量的Na、Mg、Al与过量的盐酸反应,在相同状况下,三者置换出的H2的体积之比是
(3)Na、Mg、Al与过量的盐酸反应,在相同状况下产生的氢气的体积相等,则Na、Mg、Al三种金属的物质的量之比是
考点:化学方程式的有关计算
专题:计算题
分析:(1)相同质量的不同金属与酸发生置换反应生成氢气,生成氢气的量与转移电子有关,金属转移电子越多其生成氢气的量越多;
(2)相同物质的量的不同金属与足量盐酸发生置换反应生成氢气,生成氢气的量与转移电子有关,金属转移电子越多其生成氢气的量越多;
(3)Na、Mg、Al与过量的盐酸反应,在相同状况下产生的氢气的体积相等,某种金属一个原子失去电子数越多,需要的该种金属物质的量越少.
(2)相同物质的量的不同金属与足量盐酸发生置换反应生成氢气,生成氢气的量与转移电子有关,金属转移电子越多其生成氢气的量越多;
(3)Na、Mg、Al与过量的盐酸反应,在相同状况下产生的氢气的体积相等,某种金属一个原子失去电子数越多,需要的该种金属物质的量越少.
解答:
解:三种金属与酸反应的方程式分别为2Na+2HCl=2NaCl+H2↑、Mg+2HCl=MgCl2+H2↑、2Al+6HCl=2AlCl3+3H2↑,
(1)若Na、Mg、Al三种金属质量相等,则三种金属的物质的量之比为:
:
:
,转移电子的物质的量之比=
:
:
=
:
:
=36:69:92,相同条件下,生成氢气体积之比等于转移电子的物质的量之比=36:69:92,故答案为:36:69:92;
(2)相同物质的量的Na,Mg,Al与过量的盐酸反应,转移电子的物质的量=1:2:3,相同条件下,生成氢气体积之比等于其转移电子的物质的量之比=1:2:3,故答案为:1:2:3;
(3)相同条件下生成相同体积的氢气,说明三个反应中转移电子物质的量相等,令转移电子为1mol,根据电子转移守恒,则消耗金属的物质的量之比=
:
:
=6:3:2,故答案为:6:3:2.
(1)若Na、Mg、Al三种金属质量相等,则三种金属的物质的量之比为:
| 1 |
| 23 |
| 1 |
| 24 |
| 1 |
| 27 |
| 1×1 |
| 23 |
| 1×2 |
| 24 |
| 1×3 |
| 27 |
| 1 |
| 23 |
| 1 |
| 12 |
| 1 |
| 9 |
(2)相同物质的量的Na,Mg,Al与过量的盐酸反应,转移电子的物质的量=1:2:3,相同条件下,生成氢气体积之比等于其转移电子的物质的量之比=1:2:3,故答案为:1:2:3;
(3)相同条件下生成相同体积的氢气,说明三个反应中转移电子物质的量相等,令转移电子为1mol,根据电子转移守恒,则消耗金属的物质的量之比=
| 1mol |
| 1 |
| 1mol |
| 2 |
| 1mol |
| 3 |
点评:本题考查化学方程式的计算,侧重考查分析计算能力,明确各个物理量之间的关系式即可金属,题目难度不大.

练习册系列答案
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目
下列各组物质中,不管它们以何种比例混合,只要总质量一定,充分燃烧后生成的二氧化碳的量和水的量均不变的是( )
| A、乙炔(C2H2)和甲苯(C7H8) |
| B、乙醇(CH3CH2OH)和丙醇(CH3CH2CH2OH) |
| C、乙醇(CH3CH2OH)和乙醚(C2H5OC2H5) |
| D、甲醛( HCHO)和乙酸(CH3COOH) |
某有机物中碳和氢原子个数比为3:4,不能与溴水反应却能使酸性KMnO4溶液褪色.其蒸气密度是相同状况下甲烷密度的7.5倍.在铁存在时与溴反应,能生成两种一溴代物.该有机物可能是( )
| A、CH≡C-CH3 |
B、 |
| C、CH2=CHCH3 |
D、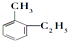 |
通常人们把质子数和电子数都相等的分子或离子叫做等电子体,等电子体间结构和性质相似,B3N3H6和C6H6的等电子体,称之为无机苯.下列关于无机苯的叙述正确的是( )
| A、B3N3H6是由极性键组成的非极性分子 |
| B、B3N3H6具有碱性 |
| C、B3N3H6能发生加成和取代反应 |
| D、B3N3H6各原子不在同一平面上 |

 某氮肥NH4HCO3中混有少量(NH4)2CO3,现采用下列方案测定该氮肥中(NH4)2CO3的质量分数:称取5.7g上述样品与2.0mol?L-1的NaOH溶液混合,完全溶解后,低温加热使其充分反应(该温度下铵盐不分解),并使生成的氨气全部被硫酸吸收,测得氨气的质量与所用NaOH溶液体积的关系如图所示.
某氮肥NH4HCO3中混有少量(NH4)2CO3,现采用下列方案测定该氮肥中(NH4)2CO3的质量分数:称取5.7g上述样品与2.0mol?L-1的NaOH溶液混合,完全溶解后,低温加热使其充分反应(该温度下铵盐不分解),并使生成的氨气全部被硫酸吸收,测得氨气的质量与所用NaOH溶液体积的关系如图所示.