题目内容
2.下列离子方程式书写正确的是( )| A. | 铁和稀硫酸反应:2Fe+6H+═2Fe3++H2↑ | |
| B. | 大理石与盐酸反应:CaCO3+2H+═Ca2++CO2↑+H2O | |
| C. | 铜和硝酸银溶液反应:Cu+Ag+=Ca2++Ag | |
| D. | 硫酸与氢氧化钡溶液反应:Ba2++SO42-=BaSO4↓ |
分析 A.铁离子与稀硫酸反应生成的是亚铁离子,不是铁离子;
B.碳酸钙与盐酸反应生成氯化钙、二氧化碳气体和水;
C.离子方程式两边正电荷不相等,违反了电荷守恒;
D.漏掉了氢离子与氢氧根离子生成水的反应.
解答 解:A.铁和稀硫酸反应生成硫酸亚铁和氢气,正确的离子方程式为:Fe+2H+═Fe2++H2↑,故A错误;
B.大理石与盐酸反应生成氯化钙、二氧化碳气体和水,反应的离子方程式为:CaCO3+2H+═Ca2++CO2↑+H2O,故B正确;
C.铜和硝酸银溶液反应生成硝酸铜和银,正确的离子方程式为:Cu+2Ag+=Ca2++2Ag,故C错误;
D.硫酸与氢氧化钡反应生成硫酸钡沉淀和水,正确的离子方程式为:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,故D错误;
故选B.
点评 本题考查了离子方程式的书写判断,为高考的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)等;试题侧重基础知识的考查,有利于提高学生的灵活应用能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
12.下列关于氯气及含氯化合物的说法中,正确的是( )
| A. | 液氯是氯气的水溶液,它能使干燥的有色布条褪色 | |
| B. | 氯气和NaOH溶液反应可制备“84”消毒液 | |
| C. | 氯气可用于自来水的杀菌消毒,是因为氯气的毒性 | |
| D. | 新制饱和氯水在光照下有气泡产生,其主要成分是氯气 |
13.下列反应属于吸热反应的是( )
| A. | 2Na+O2 $\frac{\underline{\;点燃\;}}{\;}$Na2O2 加热 | B. | HCl+NaOH=NaCl+H2O | ||
| C. | 2CaSO4 $\frac{\underline{\;加热\;}}{\;}$ 2CaO+2SO2↑+O2↑ | D. | Fe2O3+2Al $\frac{\underline{\;高温\;}}{\;}$ 2Fe+Al2O3 |
10.常温下,某溶液由水电离的c(H+)=1×10-12mol/L,下列说法错误的是( )
| A. | c(OH-)可能为0.01 mol/L | B. | c(OH-)可能为1×10-12mol/L | ||
| C. | 该溶液不可能是酸溶液 | D. | 该溶液可能是碱溶液 |
17.下列溶液中的氯离子浓度为0.3mol/L的是( )
| A. | 150ml 0.2mol/L NaCl溶液 | B. | 100ml 3mol/L NH4Cl溶液 | ||
| C. | 300ml 0.1mol/L KCl溶液 | D. | 150ml 0.1mol/L FeCl3溶液 |
7.下列反应中,属于氧化还原反应的是( )
| A. | Na2O+H2O═2NaOH | B. | 2Na2O2+2CO2═2Na2CO3+O2 | ||
| C. | Na2CO3+2HCl═2NaCl+CO2↑+H2O | D. | 2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O |
11.1.28g某气体含有的分子数目为1.204×1022,则该气体的摩尔质量为( )
| A. | 64g | B. | 64 | C. | 64g/mol | D. | 32g/mol |
16.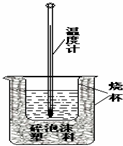 某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶 液进行中和热的测定,实验装置如图所示.
某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶 液进行中和热的测定,实验装置如图所示.
(1)该图中有两处未画出,它们是烧杯上方的泡沫塑料盖和环形玻璃搅拌棒
(2)写出该反应的热化学方程式(中和热为57.3kJ/mol):$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol
(3)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如表.
近似认为0.50mol/L NaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g•℃).则中和热△H=-53.5kJ/mol (取小数点后一位).
(4)如果用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度,中和热实验数值偏低.(填“偏高”,“无影响”或“偏低”)
 某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶 液进行中和热的测定,实验装置如图所示.
某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶 液进行中和热的测定,实验装置如图所示. (1)该图中有两处未画出,它们是烧杯上方的泡沫塑料盖和环形玻璃搅拌棒
(2)写出该反应的热化学方程式(中和热为57.3kJ/mol):$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol
(3)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如表.
| 温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | ||
| H2SO4 | NaOH | 平均值 | ||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 |
| 2 | 25.9 | 25.9 | 25.9 | 29.8 |
| 3 | 26.4 | 26.2 | 26.3 | 30.4 |
(4)如果用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度,中和热实验数值偏低.(填“偏高”,“无影响”或“偏低”)