题目内容
5.铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,且不会造成二次污染.已知高铁酸盐热稳定性差,高铁酸盐在碱性环境中比酸性环境中相对稳定.工业上用湿法制备高铁酸钾的基本流程如图所示: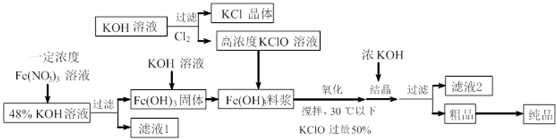
下列有关说法不正确的是( )
| A. | 控制反应温度30℃以下的原因是防止生成的K2FeO4发生分解 | |
| B. | 结晶过程中加入浓KOH溶液其作用是增大K+浓度,促进K2FeO4晶体析出 | |
| C. | 滤液2中阳离子可通过焰色反应检验确定 | |
| D. | 湿法制备高铁酸钾,也可以在Fe(OH)3料浆中直接通入足量氯气 |
分析 硝酸铁和氢氧化钾反应生成了氢氧化铁和硝酸钾,过滤后得到的滤液是硝酸钾溶液,氢氧化铁料浆和次氯酸钾反应生成了高铁酸钾,反应方程式是:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O;已知高铁酸盐热稳定性差,温度不宜过高,加入浓KOH溶液,溶液中钾离子浓度增大,有利于高铁酸钾析出滤液2主要含有KOH,以此解答该题.
解答 解:硝酸铁和氢氧化钾反应生成了氢氧化铁和硝酸钾,过滤后得到的滤液是硝酸钾溶液,氢氧化铁料浆和次氯酸钾反应生成了高铁酸钾,反应方程式是:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O;已知高铁酸盐热稳定性差,温度不宜过高,加入浓KOH溶液,溶液中钾离子浓度增大,有利于高铁酸钾析出滤液2主要含有KOH,
A.由题给信息可知,由于已知高铁酸盐热稳定性差,温度高了高铁酸钾会分解,故A正确;
B.由以上分析可知结晶过程中加入浓KOH溶液,增大了K+浓度,有利于K2FeO4晶体的析出,故B正确;
C.滤液2含有钾离子,可通过焰色反应检验确定,故C正确;
D.反应应在碱性条件下进行,且氯气不能氧化氢氧化铁,故D错误,
故选D.
点评 本题考查物质的制备,为高频考点,侧重于学生的分析、实验能力的考查,注意把握物质的性质以及题给信息,为解答该题的关键,难度中等.

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目
16.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | Na2O2与足量CO2反应,共生成0.2mol O2,转移电子的数目为0.4NA | |
| B. | 室温下,1L pH=12的Ba(OH)2溶液中,由水电离的OH-离子数目为0.01NA | |
| C. | 0.1 mol聚丙烯中含有双键的数目为0.1NA | |
| D. | 含1mol FeCl3的饱和溶液最多可形成胶体粒子数为NA |
13.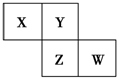 X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层是内层电子数的3倍,下列说法正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层是内层电子数的3倍,下列说法正确的是( )
 X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层是内层电子数的3倍,下列说法正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层是内层电子数的3倍,下列说法正确的是( )| A. | X的简单气态氢化物的稳定性比Y的强 | |
| B. | W的氧化物对应水化物的酸性比Z的强 | |
| C. | ZY2的水溶液具有酸性、氧化性、还原性 | |
| D. | Z和钠形成的化合物Na2Z2中只有离子键 |
20.下列说法不正确的是( )
| A. | 邻二甲苯只有一种结构,能证明苯环中不存在碳碳单键和碳碳双键交替的结构 | |
| B. | 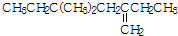 与氢气加成后的产物用系统命名法命名为3,5,5-三甲基庚烷 与氢气加成后的产物用系统命名法命名为3,5,5-三甲基庚烷 | |
| C. | 植物秸秆和土豆淀粉在一定条件下水解的产物都可以转化为酒精 | |
| D. | 完全燃烧一定质量的冰醋酸、葡萄糖混合物(以任意质量比混合),生成CO2和H2O的物质的量相同 |
10.下列说法不正确的是( )
| A. | 乙酸与乙醇生成乙酸乙酯,苯与硝酸生成硝基苯属于同一类型的反应 | |
| B. | C3H8与C4H10一定互为同系物,分子式为C2H6O的有机物有2种 | |
| C. | 石油裂解可以得到丙烯,煤干馏可以得到苯,丙烯和苯均可使溴水褪色且原理相同 | |
| D. | 植物秸秆和土豆淀粉在一定条件下水解的产物都可以转化为酒精 |
17.下列有关实验的操作、原理和现象,正确的是( )
| A. | 称取 10.1gNaOH时,将 10g的砝码放在右盘,并将游码移到 0.1g的位置 | |
| B. | 做钠与水反应的实验时,切取绿豆大小的金属钠,用滤纸吸干其表面的煤油,放入烧杯中,滴入两滴酚酞溶液,再加入少量水,然后观察并记录实验现象 | |
| C. | 向试管中加入 5mL溴水、2mL苯和 0.5g铁粉,充分振荡后静置,观察试管底部生成褐色油状液滴 | |
| D. | 为验证盐桥的作用,在两个烧杯中分别盛适量硫酸亚铁铵溶液和稀酸性高锰酸钾溶液,分 别插入石墨棒用导线与电流计相连,然后用装有 K2SO4饱和溶液的琼脂的 U型管两端插入两个烧杯中,电流计偏转,一段时间后高锰酸钾溶液褪色 |
14.明代《天工开物》记载了“火法”冶炼锌的方法:“炉甘石十斤,装载入一泥罐内,…然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,…冷淀,毁罐取出,…,即倭铅也”(注:炉甘石的主要成分为碳酸锌,泥罐中掺有煤炭).下列说法不正确的是( )
| A. | 煤炭中起作用的主要元素是碳 | |
| B. | 该冶炼锌的方法属于热还原法 | |
| C. | 倭铅是指金属锌和铅的混合物 | |
| D. | 冶炼Zn的反应方程式为ZnCO3+2C$\stackrel{△}{=}$Zn+3CO↑ |
15.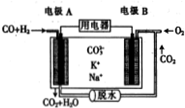 水煤气(CO、H2)作燃料电池的燃料可提高利用率和减少碳的排放,以水煤气为燃料的某熔融碳酸盐燃料电池的工作原理如图所示.下列说法正确的( )
水煤气(CO、H2)作燃料电池的燃料可提高利用率和减少碳的排放,以水煤气为燃料的某熔融碳酸盐燃料电池的工作原理如图所示.下列说法正确的( )
 水煤气(CO、H2)作燃料电池的燃料可提高利用率和减少碳的排放,以水煤气为燃料的某熔融碳酸盐燃料电池的工作原理如图所示.下列说法正确的( )
水煤气(CO、H2)作燃料电池的燃料可提高利用率和减少碳的排放,以水煤气为燃料的某熔融碳酸盐燃料电池的工作原理如图所示.下列说法正确的( )| A. | 电极A上H2参与的电极反应为H2+2OH--2e-=2H2O | |
| B. | 电极B上发生的电极反应为O2+2CO2+4e-=2CO32- | |
| C. | 电池工作时,K+向电极A移动 | |
| D. | 若电极B上消耗2molO2,则电极A上消耗4molCO |