题目内容
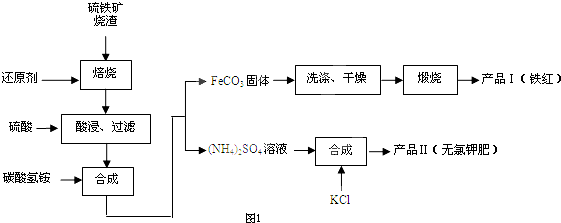
图中C至L分别表示反应中的一种常见物质,E.F.I在通常情况下是气体单质,其中E有刺激性气味,X.Y是常见的金属单质.W是由甲.乙元素按1:1的比例组成的,其中甲元素的原子的M层电子数是K层的一半,乙元素的原子最外层电子数是次外层电子数的3倍.(参加反应的水和生成的水已从图中略去)

填写空白:
(1)E是 (化学式),Y元素在周期表中的位置是 W的电子式 .
(2)写出W+L→J+C+I的化学方程式 .
(3)设计实验分离H和J(写出所用试剂和操作方法): .

填写空白:
(1)E是
(2)写出W+L→J+C+I的化学方程式
(3)设计实验分离H和J(写出所用试剂和操作方法):
考点:无机物的推断
专题:
分析:甲元素的原子的M层电子数是K层的一半,则甲为Na;乙元素的原子最外层电子数是次外层电子数的3倍,只能有2个电子层,最外层电子数为6,则乙为O元素,W是由甲、乙元素按1:1的比例组成的,则W为Na2O2,故I为O2.金属Y与刺激性气味单质气体E连续反应,Y为变价金属,E为强氧化性单质,可推知Y为Fe,E为Cl2,则K为FeCl2,L为FeCl3,J为Fe(OH)3,C为NaCl,电解C溶液得到F为H2,D为NaOH,金属X与氢氧化钠溶液中生成G与氢气,则X为Al,G为NaAlO2,则沉淀H为Al(OH)3,据此解答.
解答:
解:甲元素的原子的M层电子数是K层的一半,则甲为Na;乙元素的原子最外层电子数是次外层电子数的3倍,只能有2个电子层,最外层电子数为6,则乙为O元素,W是由甲、乙元素按1:1的比例组成的,则W为Na2O2,故I为O2.金属Y与刺激性气味单质气体E连续反应,Y为变价金属,E为强氧化性单质,可推知Y为Fe,E为Cl2,则K为FeCl2,L为FeCl3,J为Fe(OH)3,C为NaCl,电解C溶液得到F为H2,D为NaOH,金属X与氢氧化钠溶液中生成G与氢气,则X为Al,G为NaAlO2,则沉淀H为Al(OH)3,
(1)由上述分析可知,E是Cl2,Y为Fe元素,在周期表中的位置是第四周期第Ⅷ族,W为Na2O2,其电子式为 ,故答案为:Cl2;第四周期第Ⅷ族;
,故答案为:Cl2;第四周期第Ⅷ族; ;
;
(2)W+L→J+C+I的化学方程式为:4Na2O2+4FeCl2+6H2O═4Fe(OH)3↓+8NaCl+O2↑,
故答案为:4Na2O2+4FeCl2+6H2O═4Fe(OH)3↓+8NaCl+O2↑;
(3)分离Al(OH)3和Fe(OH)3实验方案为:向混合物中加足量的NaOH溶液,过滤,洗涤滤渣得Fe(OH)3,向滤液中通入足量的CO2,再过滤洗涤滤渣得Al(OH)3,
故答案为:向混合物中加足量的NaOH溶液,过滤,洗涤滤渣得Fe(OH)3,向滤液中通入足量的CO2,再过滤洗涤滤渣得Al(OH)3.
(1)由上述分析可知,E是Cl2,Y为Fe元素,在周期表中的位置是第四周期第Ⅷ族,W为Na2O2,其电子式为
 ,故答案为:Cl2;第四周期第Ⅷ族;
,故答案为:Cl2;第四周期第Ⅷ族; ;
;(2)W+L→J+C+I的化学方程式为:4Na2O2+4FeCl2+6H2O═4Fe(OH)3↓+8NaCl+O2↑,
故答案为:4Na2O2+4FeCl2+6H2O═4Fe(OH)3↓+8NaCl+O2↑;
(3)分离Al(OH)3和Fe(OH)3实验方案为:向混合物中加足量的NaOH溶液,过滤,洗涤滤渣得Fe(OH)3,向滤液中通入足量的CO2,再过滤洗涤滤渣得Al(OH)3,
故答案为:向混合物中加足量的NaOH溶液,过滤,洗涤滤渣得Fe(OH)3,向滤液中通入足量的CO2,再过滤洗涤滤渣得Al(OH)3.
点评:本题考查无机物推断,难度中等,涉及电解原理以及钠、氯、铁等元素化合物性质,需要学生熟练掌握元素化合物知识,注意充分利用题目信息进行推断.

练习册系列答案
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案
相关题目
下列说法不正确的是( )
| A、糖类和蛋白质都能发生水解反应 |
| B、鸡蛋清和淀粉溶液可以用浓硝酸鉴别 |
| C、甲苯和乙酸在一定条件下都能发生取代反应 |
| D、植物油和石油的裂化产物均能使酸性KMnO4溶液褪色 |
下列关于一些常见物质的说法中,正确的是( )
| A、煤经气化和液化两个物理变化过程,可变为清洁能源 |
| B、棉、麻、丝、毛、皮以及合成纤维完全燃烧只生成H2O和 CO2 |
| C、“地沟油”可用于制备生物柴油 |
| D、石英玻璃、钢化玻璃、玻璃钢、防弹玻璃都是硅酸盐制品 |
用石墨电极电解足量M(NO3)x的水溶液,当阴极上增重a g时,在阳极上同时产生b L氧气(标准状况),从而可知M的相对原子质量为( )
A、
| ||
B、
| ||
C、
| ||
D、
|
在新制的氯水中存在平衡:Cl2+H2O?HCl+HClO.加入少量下列物质能使c(HClO)增大的是( )
| A、CaCO3 |
| B、CaSO3 |
| C、NaOH |
| D、HCl |
下列说法正确的是( )
| A、1 mol氢的质量为2g |
| B、OH-的摩尔质量为17g |
| C、标准状况下,水的摩尔体积是22.4 L?mol-1 |
| D、1mol Ne 含有的电子数目为6.02×1024 |