题目内容
铝粉、磁性氧化铁、氯酸钾、镁条一定条件下发生铝热反应: .
考点:铝的化学性质
专题:元素及其化合物
分析:铝粉与磁性氧化铁(Fe3O4)混合在引燃条件下发生反应,产生高温的同时生成氧化铝(Al2O3)和铁(液态,用于焊接),以此书写反应的化学方程式.
解答:
解:铝粉与磁性氧化铁(Fe3O4)混合在引燃条件下发生反应,产生高温的同时生成氧化铝(Al2O3)和铁,反应为8Al+3Fe3O4
4Al2O3+9Fe,
故答案为:8Al+3Fe3O4
4Al2O3+9Fe.
| ||
故答案为:8Al+3Fe3O4
| ||
点评:本题考查Al的化学性质及化学反应方程式的书写,把握反应物、生成物及反应实质为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
下列有关电解质溶液中微粒的物质的量浓度关系正确的是( )
| A、在0.1 mol?L-1Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+c(H2CO3) |
| B、在0.1 mol?L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
| C、向0.2 mol?L-1NaHCO3溶液中加入等体积0.1 mol?L-1NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
| D、常温下,CH3COONa和CH3COOH混合溶液[pH=7,c(Na+)=0.1 mol?L-1]:c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-) |
电子式正确的是( )
A、醛基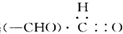 |
B、氨基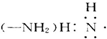 |
C、一种碳正离子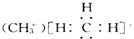 |
D、乙氧基离子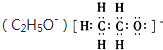 |
浓度均为0.1mol?Lˉ1的下列各组溶液,pH前者大于后者的是( )
| A、Na2CO3、NaHCO3 |
| B、NaH2PO4、Na2HPO4 |
| C、NaHSO4、NaHCO3 |
| D、Na2SO4、CH3COONa |
下列说法正确的是( )
| A、向等体积的20%的H2O2溶液和10%的H2O2溶液中分别滴加等体积的0.1mol?L-1 FeCl3溶液和0.1mol?L-1CuCl2溶液,前者产生气泡快,这个实验可以充分证明催化剂具有选择性 |
| B、不能用带玻璃塞的玻璃瓶和酸式滴定管盛取碱液,二者的原因是相同 |
| C、将0.1 mol?L-1醋酸加水稀释,溶液中各离子浓度均减小 |
| D、室温下同浓度、同体积的强酸与强碱溶液混合后,溶液的pH=7 |
下列实验操作中所用仪器合理的是( )
| A、用100 mL的量筒量取18.8 mL NaOH溶液 |
| B、用瓷坩埚加热熔融NaOH |
| C、用托盘天平称取25.2 0g氯化钠 |
| D、用100 m L容量瓶制备7 0 mL0.1 mo l?L-1盐酸 |
 属于
属于 属于
属于