题目内容
下列叙述不正确或不够严谨的是( )
| A、将铜片放入浓硫酸中,无明显实验现象,说明铜在冷的浓硫酸中发生钝化 |
| B、有化学键断裂的变化不一定是化学变化 |
| C、IA族元素形成的单质的熔点随原子序数的递增而降低 |
| D、无色透明溶液一定不是水 |
考点:浓硫酸的性质,元素周期律的作用,化学键
专题:
分析:A.铜与浓硫酸在加热条件下发生反应;
B.氯化钠溶液水,有化学键的断裂;
C.IA族元素包括氢和碱金属元素;
D.溶液是混合物.
B.氯化钠溶液水,有化学键的断裂;
C.IA族元素包括氢和碱金属元素;
D.溶液是混合物.
解答:
解:A.铜与浓硫酸在加热条件下发生反应,故A错误;
B.氯化钠溶液水,有化学键的断裂,但是没有新键的形成,不属于化学变化,故B正确;
C.氢气常温下为气体,在IA族元素形成的单质中熔点最低,故C错误;
D.溶液是混合物,水是纯净物,故D正确;
故选:AC.
B.氯化钠溶液水,有化学键的断裂,但是没有新键的形成,不属于化学变化,故B正确;
C.氢气常温下为气体,在IA族元素形成的单质中熔点最低,故C错误;
D.溶液是混合物,水是纯净物,故D正确;
故选:AC.
点评:本题考查了元素化合物的性质,题目难度不大,明确物质的性质、化学反应的实质是解题关键,注意相关知识的积累.

练习册系列答案
相关题目
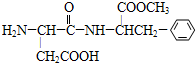 代糖是一种人工合成的甜味剂(sweetener),由于它不会被消化而变为能量共给身体所需,所以适合一些减肥人士食用.目前为止,天冬酰苯丙氨酸甲酯(aspartame)尚未有证据证实它是致癌物质,是糖的最佳代用品,比一般的蔗糖甜160倍.请根据图结构式判断下列关于aspartame的描述正确的是( )
代糖是一种人工合成的甜味剂(sweetener),由于它不会被消化而变为能量共给身体所需,所以适合一些减肥人士食用.目前为止,天冬酰苯丙氨酸甲酯(aspartame)尚未有证据证实它是致癌物质,是糖的最佳代用品,比一般的蔗糖甜160倍.请根据图结构式判断下列关于aspartame的描述正确的是( )| A、是芳香烃 |
| B、分子式是C14H19N2O5 |
| C、具有两性 |
| D、1mol aspartame最多能与3mol NaOH反应 |
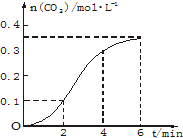 CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图.下列结论正确的是( )
CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图.下列结论正确的是( )| A、反应开始4 min内温度对反应速率的影响比浓度小 |
| B、反应4 min后平均反应速率最小 |
| C、反应开始2 min内平均反应速率最大 |
| D、反应在第2 min到第4 min间生成CO2的平均反应速率为 v(CO2)=0.1 mo1?(L?min)-1 |
观察是研究物质性质的一种基本方法.某同学将一小块金属钠露置于空气中,观察到下列现象:银白色
变灰暗
变白色
出现液滴
白色固体,则下列说法正确的是( )
| ① |
| ② |
| ③ |
| ④ |
| A、①发生氧化还原反应生成了过氧化钠 |
| B、④只发生物理变化 |
| C、③是碳酸钠吸收空气中的水蒸气形成了溶液 |
| D、②变白色主要是因为生成了氢氧化钠 |
下列各溶液中,粒子的物质的量浓度关系正确的是( )
| A、0.1 mol/L Na2CO3溶液:c(Na+)=2[c(CO32-)+c(HCO3-)+2c(H2CO3)] |
| B、pH约为4的 NaHSO3溶液:c(HSO3-)>c(SO32-)>c (H2SO3) |
| C、向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| D、向高锰酸钾溶液中滴加草酸溶液得到的pH=5的混合溶液:c(K+)=c(MnO4-) |
在密闭容器中,有可逆反应:nA(气)+mB(气)?pC(气)△H=Q处于平衡状态(已知m+n>p,Q>0)下列说法中正确的是( )
①升高温度时,[B]/[C]的值减小;②降温时,体系内混合气体的平均摩尔质量减小;③加入B后,A的转化率变大;④加入催化剂,气体总物质的量不变;⑤充入C后,A,B的物质的量增大.
①升高温度时,[B]/[C]的值减小;②降温时,体系内混合气体的平均摩尔质量减小;③加入B后,A的转化率变大;④加入催化剂,气体总物质的量不变;⑤充入C后,A,B的物质的量增大.
| A、③④ | B、②③⑤ |
| C、①②⑤ | D、全部 |
某单质能和浓硝酸反应,若参加反应的单质与硝酸的物质的量之比为1:4,则组成该单质的元素在产物中的化合价可能是( )
| A、+1 | B、+2 | C、+3 | D、+4 |
1体积某气态烃A最多和2体积氯化氢加成生成氯代烷烃,1mol此氯代烷烃能和6molCl2发生取代反应,生成物中只有碳、氯两种元素,则A的化学式( )
| A、C3H4 |
| B、C2H4 |
| C、C4H6 |
| D、C2H2 |