题目内容
12.在平板电视显示屏生产过程中产生的废玻璃粉末中含有二氧化铈(CeO2).(1)在空气中煅烧Ce(OH)CO3可制备CeO2,该反应的化学方程式4Ce(OH)CO3+O2=4CeO2+4CO2+2H2O
(2)已知在一定条件下,电解熔融状态的CeO2可制备Ce,写出阴极的电极反应式Ce4++4e-=Ce;
(3)某课题组以上述废玻璃粉末(含有SiO2、Fe2O3、CeO2以及其他少量不溶于稀酸的物质)为原料,设计如图1流程对资源进行回收,得到Ce(OH)4和硫酸铁铵.

①得到滤渣B时,需要将其表面杂质洗涤干净.检验滤渣B已经洗涤干净的方法是取最后一次的洗涤液滴入KSCN溶液无变化,加入氯水若不变红色,证明洗涤干净.
②反应(1)的离子方程式为2CeO2+H2O2+6H+=2Ce3++O2↑+4H2O.
③操作I的名称是冷却结晶
④如图2,氧化还原滴定法测定制得的Ce(OH)4产品的纯度.
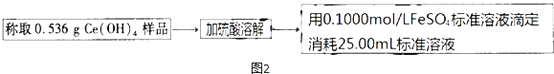
该产品中Ce(OH)4的质量分数为65.30%(保留小数点后两位).若滴定所用FeSO4溶液已在空气中露置了一段时间,则测得该Ce(OH)4产品的纯度偏高(“偏高”、“偏低”或“无影响”).
分析 (1)在空气中煅烧Ce(OH)CO3可制备CeO2,结合质量守恒定律书写化学方程式;
(2)电解熔融状态的CeO2可制备Ce,在阴极获得铈,阴极是Ce4+离子得到电子生成Ce;
(3)废玻璃粉末加氢氧化钠溶液后过滤,得到滤渣A的成分是Fe2O3、CeO2、FeO;滤渣A(Fe2O3、CeO2、FeO)加稀硫酸后过滤得滤液B是硫酸亚铁溶液,加入氧化剂C可生成硫酸铁,所加氧化剂应避免引入新杂质,滤渣B的成分是CeO2;CeO2与H2O2和稀H2SO4反应生成Ce3+和O2;Ce3+加碱生成Ce(OH)3悬浊液;Ce(OH)3悬浊液被氧化生成Ce(OH)4;
①固体表面可吸附Fe3+、Fe2+;
②CeO2与H2O2反应生成Ce2(SO4)3和O2;
③根据操作流程判断,由溶液生成固体,应首先进行蒸发浓缩,然后冷却结晶;
④依据滴定过程反应的定量关系计算Ce(OH)4质量分数,FeSO4溶液在空气中露置一段时间后会被氧化,消耗硫酸亚铁增大,测定该Ce(OH)4产品的质量分数会增大.
解答 解:(1)在空气中煅烧Ce(OH)CO3可制备CeO2,该反应方程式为4Ge(OH)CO3+O2═4GeO2+4CO2+2H2O,
故答案为:4 Ce(OH)CO3+O2=4CeO2+4CO2+2H2O;
(2)电解熔融状态的CeO2可制备Ce,在阴极获得铈,阴极是Ce4+离子得到电子生成Ce,电极反应为:Ce4++4e-=Ce,故答案为:Ce4++4e-=Ce;
(3)废玻璃粉末加氢氧化钠溶液后过滤,得到滤渣A的成分是Fe2O3、CeO2、FeO;滤渣A(Fe2O3、CeO2、FeO)加稀硫酸后过滤得滤液B是硫酸亚铁溶液,加入氧化剂C可生成硫酸铁,所加氧化剂应避免引入新杂质,滤渣B的成分是CeO2;CeO2与H2O2和稀H2SO4反应生成Ce3+和O2;Ce3+加碱生成Ce(OH)3悬浊液;Ce(OH)3悬浊液被氧化生成Ce(OH)4,
①滤渣A的成分是Fe2O3、CeO2、FeO,与硫酸反应后溶液中存在Fe3+、Fe2+,固体表面可吸附Fe3+、Fe2+,检验滤渣B已经洗涤干净的方法是取最后一次的洗涤液滴入KSCN溶液无变化,加入氯水若不变红色,证明洗涤干净,
故答案为:取最后一次的洗涤液滴入KSCN溶液无变化,加入氯水若不变红色,证明洗涤干净;
②CeO2与H2O2反应生成Ce2(SO4)3和O2,反应的方程式为2CeO2+H2O2+3H2SO4=Ce2(SO4)3+O2↑+4H2O,离子方程式为:2CeO2+H2O2+6H+=2Ce3++O2↑+4H2O,
故答案为:2CeO2+H2O2+6H+=2Ce3++O2↑+4H2O;
③根据操作流程判断,由溶液生成固体,应首先进行蒸发浓缩,然后冷却结晶,故答案为:冷却结晶;
④称取0.536g样品,加入硫酸溶解,用0.1000mol/LFeSO4溶液滴定,消耗25.00ml溶液,
Ce4++Fe2+=Fe3++Ce3+,
依据元素守恒计算n(Ce(OH)4)=n(Fe2+)=0.1000mol/L×0.0250L=2.5×10-3mol,含量=$\frac{2.5×10{\;}^{-3}mol×208g/mol}{0.536g}$×100%=65.30%
FeSO4溶液在空气中露置一段时间后会被氧化,消耗硫酸亚铁增大,测定该Ce(OH)4产品的质量分数会偏高,
故答案为:65.30%;偏高.
点评 本题以工艺流程为基础,考查了化学实验基本操作、元素及化合物知识反应等相关知识,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握实验的原理和操作方法,题目难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | 含NA个阴离子的Na2O2溶于水形成1L溶液,其物质的量的浓度为1mol/L | |
| B. | 25g质量分数为68%的H2O2水溶液中含有氧原子数目为NA | |
| C. | 常温常压下,0.1molD2O含有中子数为NA | |
| D. | 用5mL3mol/LFeCl3溶液制成的氢氧化铁胶体中所含胶粒数为0.015 NA |
①混合物:水玻璃、水银、水煤气
②电解质:明矾、冰醋酸、石膏
③酸性氧化物:CO2、Al2O3、SO3
④同位素:1H、2H2、3H
⑤同素异形体:C60、金刚石、石墨
⑥干冰、液氯都是非电解质.
| A. | ①②③④⑤⑥ | B. | ④⑥ | C. | ②⑤⑥ | D. | ②⑤ |
 对氯苯甲酸是合成非甾族消炎镇痛药的中间体,还能用于燃料和浓药的合成,实验室中制备对氯苯甲酸的反应、装置图如图:
对氯苯甲酸是合成非甾族消炎镇痛药的中间体,还能用于燃料和浓药的合成,实验室中制备对氯苯甲酸的反应、装置图如图: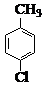 $→_{催化剂}^{KMnO_{4}}$
$→_{催化剂}^{KMnO_{4}}$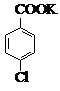 +MnO2
+MnO2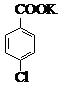
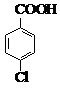
常温条件下的有关数据如下表所示:
| 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 颜色 | 水溶性 | |
| 对氯甲苯 | 7.5 | 162 | 1.07 | 无色 | 难溶 |
| 对氯苯甲酸 | 243 | 275 | 1.54 | 白色 | 微溶 |
| 对氯苯甲酸钾 | 具有盐的通性,属于可溶性盐 | ||||
请回答下列问题:
(1)装置B的名称是冷凝管.
(2)量取6.00mL对氯甲苯应选用的仪器是C.
A.10mL量筒 B.50mL容量瓶 C.50mL酸式滴定管 D.50mL碱式滴定管
(3)控制温度为93℃左右的方法是水浴加热.对氯甲苯的加入方法是逐滴加入而不是一次性加入,原因是减少对氯甲苯的挥发,提高原料利用率.
(4)第一次过滤的目的是除去MnO2,滤液中加入稀硫酸酸化,可观察到的实验现象是产生白色沉淀.
(5)第二次过滤所得滤渣要用冷水进行洗涤,其原因是可除去对氯苯甲酸表面的可溶性杂质且尽量减小对氯苯甲酸的损耗.
(6)本实验的产率是D(填标号).
A.60% B.70% C.80% D.90%

已知:Ⅰ.SrCl2•6H2O 晶体在61℃时开始失去结晶水,100℃时失去全部结晶水.
Ⅱ.有关氢氧化物开始沉淀和完全沉淀的pH如表:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 |
| 沉淀完全的pH | 3.7 | 9.7 |
(2)酸性条件下,加入30% H2O2溶液,将Fe2+氧化成Fe3+,其离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.能否用新制氯水代替双氧水能(填“能”或“否”).
(3)在步骤②-③的过程中,将溶液的pH值由1调节至B;宜用的试剂为EG.
A.1.5 B.4 C.9.7
D.氨水 E.氢氧化锶粉末 F.碳酸钠晶体 G.氧化锶粉末
(4)操作③中所得滤渣的主要成分是Fe(OH)3、BaSO4(填化学式).
(5)工业上用50~60℃热风吹干六水氯化锶,选择该温度的原因是温度高有利于除去湿存(晶体表面附着的)水,但温度高于61℃时,氯化锶晶体中的结晶水也会失去.
(6)步骤⑥中,洗涤氯化锶晶体最好选用D.
A.水 B.稀硫酸 C.氢氧化钠溶液 D.氯化锶饱和溶液.
| 序号 | 物质 | 杂质 | 除杂试剂或操作方法 |
| ① | NaCl溶液 | Na2CO3 | 加入盐酸,蒸发 |
| ② | FeSO4溶液 | CuSO4 | 加入过量铁粉并过滤 |
| ③ | H2 | CO2 | 依次通过盛有NaOH溶液和浓硫酸的洗气瓶 |
| ④ | NaNO3 | CaCO3 | 加稀盐酸溶解、过滤、蒸发、结晶 |
| A. | ①②③ | B. | ②③④ | C. | ①③④ | D. | ①②③④ |
| A. | c=$\frac{m}{VM}$ | B. | m=ρVM | C. | W%=$\frac{cM}{1000p}$% | D. | c=$\frac{1000ρW%}{M}$ |
 ;AB2的结构式是O=C=O.
;AB2的结构式是O=C=O.