题目内容
12.将一定体积的CO2通入到一定浓度的NaOH溶液中,为了测定其溶液的成分,向该溶液中逐滴加入1mol•L-1盐酸.所加入盐酸的体积与产生CO2气体体积(标准状况)的关系如图所示.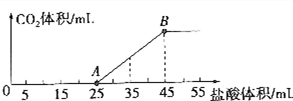
(1)写出OA段所发生反应的离子方程式:H++OH-═H2O;CO32-+H+═HCO3-.
(2)当加入35mL盐酸时,所产生的CO2的体积是224mL(标准状况).
(3)溶液中所含的物质有氢氧化钠和碳酸钠,其物质的量之比为1:4.
分析 (1)在溶液中碳酸氢钠与氢氧化钠反应生成碳酸钠,结合图象可知,开始没有二氧化碳气体生成,则制成的稀溶液中的溶质为碳酸钠和氢氧化钠,则OA段先发生酸碱中和,再发生碳酸钠与盐酸反应生成碳酸氢钠与氯化钠.
(2)结合图象可知,当加入35mL盐酸时,25~35mL发生碳酸氢钠与盐酸的反应生成二氧化碳气体;
(3)溶液中所含的物质有碳酸钠和氢氧化钠,由图可知氢氧化钠消耗盐酸的体积为5ml,而碳酸钠生成碳酸氢钠消耗盐酸为:20ml,碳酸钠和氢氧化钠与盐酸都是1:1反应,所以其物质的量之比等于消耗盐酸的体积之比.
解答 解:(1)在溶液中碳酸氢钠与氢氧化钠反应生成碳酸钠,结合图象可知,开始没有二氧化碳气体生成,则制成的稀溶液中的溶质为碳酸钠和氢氧化钠,则OA段0~5mL先发生酸碱中和,其离子反应方程式为H++OH-═H2O,再发生碳酸钠与盐酸反应生成碳酸氢钠与氯化钠,其离子反应方程式为CO32-+H+═HCO3-,
故答案为:H++OH-═H2O;CO32-+H+═HCO3-;
(2)结合图象可知,当加入35mL盐酸时,25~35mL发生碳酸氢钠与盐酸的反应生成二氧化碳气体,设生成二氧化碳的物质的量为n,生成气体时消耗的酸的物质的量为(35-25)×10-3L×1mol•L-1=0.01mol,则
HCO3-+H+═CO2↑+H2O
1 1
0.01mol n
,所以n=0.01mol,标准状况下其体积为0.01mol×22.4L/mol=0.224L=224mL,故答案为:224;
(3)溶液中所含的物质有碳酸钠和氢氧化钠,由图可知氢氧化钠消耗盐酸的体积为5ml,而碳酸钠生成碳酸氢钠消耗盐酸为:20ml,碳酸钠和氢氧化钠与盐酸都是1:1反应,所以其物质的量之比等于消耗盐酸的体积之比,则物质的量之比为5:20=1:4,故答案为:氢氧化钠和碳酸钠;1:4.
点评 本题考查混合物计算,根据消耗盐酸的体积判断图象中各阶段发生的反应是解答的关键,侧重考查学生分析思维能力,难度大.

| A. | 装碱液的锥形瓶用NaOH溶液润洗 | |
| B. | 滴定时,眼睛注视酸式滴定管中液面的下降情况 | |
| C. | 应用右手控制酸式滴定管的活塞 | |
| D. | 若用甲基橙作指示剂,到滴定终点时锥形瓶内液体为橙色 |
| A. | ①②③④⑤ | B. | ④③①②⑤ | C. | ④①②③⑤ | D. | ②③①④⑤ |
①任何原子都是电中性的;
②原子像带正电的海洋,电子漂在正电荷的海洋中;
③原子是由带正电的物质和电子构成的;
④阴极射线产生的原因是电子很小,在原子受打击时电子就容易跑出去.
| A. | ①②④ | B. | ① | C. | ①②③ | D. | ①②③④ |
| A. | 向氯化铝溶液中滴加过量的氨水:4NH3•H2O+Al3+═AlO2-+4NH4++2H2O | |
| B. | NH4Al(SO4)2溶液中滴加少量NaOH溶液:Al3++NH4++4OH-=Al(OH)3↓+NH3•H2O | |
| C. | 向明矾溶液中加入过量的Ba(OH)2溶液:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O | |
| D. | 向NaAlO2溶液中通入足量CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |
| A. | $\frac{39a}{18b+39a}×100%$ | B. | $\frac{1000ρa}{56a+18b}mol/L$ | ||
| C. | $\frac{a}{56a+18b}mol/L$ | D. | $\frac{56a}{56a+18b}%$ |
| A. | 0.1 mol•L-1•s-1 | B. | 0.15 mol•L-1•s-1 | ||
| C. | 0.2 mol•L-1•s-1 | D. | 0.3mol•L-1•s-1 |
| A. | 某有机物的结构简式如图所示 ,该物质属于芳香族化合物是苯的含氧衍生物,含有两种含氧官能团 ,该物质属于芳香族化合物是苯的含氧衍生物,含有两种含氧官能团 | |
| B. | 按系统命名法,有机物(CH3)2CHCH(CH2CH3)(CH2CH2CH3)的命名为:2-甲基-3-乙基己烷 | |
| C. | 总质量一定时,乙炔和乙醛(CH3CHO)无论按什么比例混合,完全燃烧消耗氧气量或生成CO2量不变 | |
| D. | 丙烯酸(CH2═CHCOOH)和山梨酸(CH3CH═CHCH═CHCOOH)不是同系物,它们与氢气充分反应后的产物才是同系物 |
 .
.