题目内容
5.等质量的O2和CO2相比较,下列叙述正确的是( )| A. | 物质的量之比为8:11 | B. | 密度比8:11 | ||
| C. | 体积比为11:8 | D. | 原子个数之比为11:12 |
分析 根据n=$\frac{m}{M}$来计算、比较O2和CO2的物质的量,根据阿伏加德罗定律的推论:同温同压下,气体的体积之比等于物质的量之比;同温同压下,气体密度之比等于摩尔质量的之比;同温同压下,分子数之比等于物质的量之比,以此解答该题.
解答 解:A.二者的质量都是mg,则O2和CO2的物质的量分别为$\frac{m}{32}$mol、$\frac{m}{44}$mol,物质的量之比为$\frac{m}{32}$:$\frac{m}{44}$=11:8,故A错误;
B.同温同压下,气体密度之比等于摩尔质量的之比,即为32:44=8:11,但气体存在的条件是否一致未知,不能确定,故B错误;
C.同温同压下,体积之比等于物质的量之比,即为$\frac{m}{32}$:$\frac{m}{44}$=11:8,但体存在的条件是否一致未知,不能确定,故C错误;
D.同温同压下,分子数之比等于物质的量之比,即分子数之比是11:8,所以原子数之比是(11×2):(8×3)=22:24=11:12,故D正确.
故选D.
点评 本题考查学生利用质量、摩尔质量、物质的量的关系来计算,明确同温同压下,物质的量之比等于体积比等于分子数之比是解答的关键,易错点为BC,注意气体存在的外界条件不一定相同.

练习册系列答案
相关题目
15.下列有关Na2CO3和NaHCO3性质比较中,正确的是( )
| A. | 热稳定性:Na2CO3<NaHCO3 | |
| B. | 常温时水溶液中的溶解度:Na2CO3>NaHCO3 | |
| C. | 与稀盐酸反应快慢:Na2CO3<NaHCO3 | |
| D. | 物质的量相同时,消耗盐酸:Na2CO3<NaHCO3 |
13.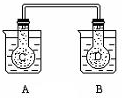 如图所示,在常况下容器A中盛有500mL蒸馏水,在容器B中盛有 500ml 1mol/L的盐酸,在烧瓶C和D中充满二氧化氮气体,并用导管将它们连通.向A容器中加入50g硝酸铵晶体,小心搅拌,使其迅速溶解;向B中加入10g苛性钠固体,小心搅拌也使其迅速溶解,随着A、B中固体物质的溶解,烧瓶C和D中气体的颜色变化是( )
如图所示,在常况下容器A中盛有500mL蒸馏水,在容器B中盛有 500ml 1mol/L的盐酸,在烧瓶C和D中充满二氧化氮气体,并用导管将它们连通.向A容器中加入50g硝酸铵晶体,小心搅拌,使其迅速溶解;向B中加入10g苛性钠固体,小心搅拌也使其迅速溶解,随着A、B中固体物质的溶解,烧瓶C和D中气体的颜色变化是( )
 如图所示,在常况下容器A中盛有500mL蒸馏水,在容器B中盛有 500ml 1mol/L的盐酸,在烧瓶C和D中充满二氧化氮气体,并用导管将它们连通.向A容器中加入50g硝酸铵晶体,小心搅拌,使其迅速溶解;向B中加入10g苛性钠固体,小心搅拌也使其迅速溶解,随着A、B中固体物质的溶解,烧瓶C和D中气体的颜色变化是( )
如图所示,在常况下容器A中盛有500mL蒸馏水,在容器B中盛有 500ml 1mol/L的盐酸,在烧瓶C和D中充满二氧化氮气体,并用导管将它们连通.向A容器中加入50g硝酸铵晶体,小心搅拌,使其迅速溶解;向B中加入10g苛性钠固体,小心搅拌也使其迅速溶解,随着A、B中固体物质的溶解,烧瓶C和D中气体的颜色变化是( )| A. | 不变 | B. | 烧瓶C中颜色变深,D中变浅 | ||
| C. | 烧瓶D中变深,C中变浅 | D. | 两个烧瓶中的颜色都变深 |
17.下列有关焰色反应的叙述正确的是( )
| A. | 氯化钠在火焰上灼烧时使火焰呈黄色,是因为氯化钠发生了分解反应 | |
| B. | 用焰色反应可以鉴别KCl和KNO3 | |
| C. | 连续做两个样品时,应将铂丝用硫酸洗净并灼烧到无特殊焰色 | |
| D. | 如透过蓝色的钴玻璃能够观察到紫色火焰,则肯定有K元素,可能有Na元素 |
14.Cu与浓硝酸反应生成氮的氧化物,这些氧化物恰好溶解在NaOH溶液中得到NaNO3和NaNO2的混合溶液,反应过程及有关数据如图表示:下列有关判断正确的是( )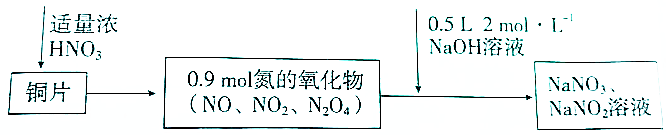

| A. | 若铜片为51.2g.则生成0.2molNaNO3 | |
| B. | 常温下,Cu遇浓硝酸发生钝化.不可能发生上述反应 | |
| C. | 标准状况下收集的氮氧化物为20.16L | |
| D. | 反应过程中生成的Cu(N03)2既是氧化产物,也是还原产物 |
