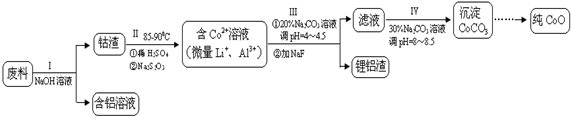
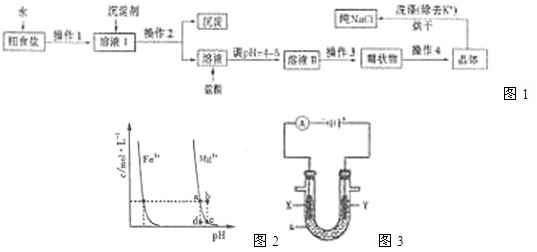
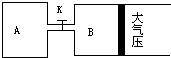
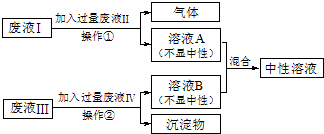
题目内容
在一定条件下,向2L密闭容器中加入一定量A,发生如下反应并建立平衡:A(g)?2B(g),2B(g)?C(g)+2D(g),测得平衡时n(A)=0.3mol,n(B)=0.2mol,n(C)=0.5mol,则最初向容器中加入的A是( )
| A、0.6mol |
| B、0.9mol |
| C、1.2mol |
| D、1.5mol |
考点:化学平衡的计算
专题:
分析:先根据C的物质的量及反应方程式可计算分解的B的物质的量,从而得出生成B的总物质的量,再根据方程式可计算出A的初始物质的量即可.
解答:
解:2B(g)?2D(g)+C(g)
转化:1mol 0.5mol
剩余:0.2mol
起始时:1.2mol,
则 A(g)?2B(g)
转化:0.6mol 1.2mol
剩余:0.3mol
起始:0.9 mol,
所以最初加入的A物质的量为:0.9 mol,
故选B.
转化:1mol 0.5mol
剩余:0.2mol
起始时:1.2mol,
则 A(g)?2B(g)
转化:0.6mol 1.2mol
剩余:0.3mol
起始:0.9 mol,
所以最初加入的A物质的量为:0.9 mol,
故选B.
点评:本题考查了化学平衡的计算,题目难度中等,根据反应明确各组分之间的关系为解答关键,注意掌握有关化学平衡的计算方法,试题侧重考查学生的分析问题、解决问题能力及化学计算能力.

练习册系列答案
 高中必刷题系列答案
高中必刷题系列答案
相关题目
为达到预期的实验目的,下列操作正确的是( )
| A、预制备Fe(OH)3胶体,向盛有沸水的烧杯中滴加FeCl3饱和溶液并长时间煮沸 |
| B、用碘的水溶液鉴别乙醇、四氯化碳 |
| C、欲配制质量分数为10%的CuSO4溶液,将10gCuSO4?5H2O溶解在90g水中 |
| D、某同学用托盘天平称量5.85gNaCl固体 |
下列溶液分pH一定小于7的是( )
| A、等体积的盐酸和氨水的混合液 |
| B、水电离出的c(OH-)=1×10-3mol?L-1的溶液 |
| C、80℃时的氯化钠溶液 |
| D、c(H+)=1×10-3mol?L-1的酸雨c(OH-)=1×10-3mol?L-1的碱等体积混合液 |
下列溶液中Cl-的浓度与50mL 1mol/L的MgCl2溶液中的Cl-浓度相等的是( )
| A、50 mL 0.5 mol/L的AlCl3溶液 |
| B、100 mL 2 mol/L的NaCl溶液 |
| C、1 L 0.2 mol/L的KCl溶液 |
| D、20 mL 0.5 mol/L的CaCl2溶液 |