题目内容
7.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压.高铁电池的总反应为:3Zn+2K2FeO4+8H2O$?_{充电}^{放电}$3Zn(OH)2+2Fe(OH)3+4KOH.下列叙述不正确的是( )| A. | 放电时每转移3 mol电子,正极有1mol K2FeO4被氧化 | |
| B. | 充电时阳极反应为:Fe(OH)3-3e-+5OH-=FeO42-+4H2O | |
| C. | 放电时锌失去电子,发生氧化反应 | |
| D. | 放电时负极附近溶液的碱性降低 |
分析 根据电池的总反应可知,高铁电池放电时必定是锌在负极失去电子,电极反应式为Zn-2e-+2OH-=Zn(OH)2,高铁酸钠在正极得到电子,电极反应式为FeO42+4H2O+3e-=Fe(OH)3+5OH-,根据电极反应式可判断电子转移的物质的量与反应物之间的关系,充电时,阳极上氢氧化铁转化成高铁酸钠,电极反应式为Fe(OH)3+5OH-=FeO42+4H2O+3e-,阳极消耗OH-离子,碱性要减弱.
解答 解:A、放电时正极反应为FeO42+4H2O+3e-=Fe(OH)3+5OH-,每转移3mol电子,正极有1molK2FeO4被还原,故A错误;
B、充电时阳极发生Fe(OH)3失电子的氧化反应,即反应为:Fe(OH)3-3e-+5OH-=FeO42-+4H2O,故B正确;
C、根据电池的总反应可知,高铁电池放电时必定是锌在负极失去电子发生氧化反应,故C正确;
D、放电时锌在负极失去电子,电极反应式为Zn-2e-+2OH-=Zn(OH)2,碱性要降低,故D正确;
故选A.
点评 本题主要考查学生运用所学化学知识综合分析和解决实际问题的能力,增加了学生分析问题的思维跨度,强调了学生整合知识的能力.

练习册系列答案
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目
17.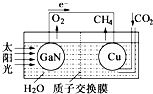 科学家用氮化镓材料与铜组装如图的人工光合系统,利用该装置成功地实现了以
科学家用氮化镓材料与铜组装如图的人工光合系统,利用该装置成功地实现了以
CO2和H2O合成CH4.以下说法错误的是( )
 科学家用氮化镓材料与铜组装如图的人工光合系统,利用该装置成功地实现了以
科学家用氮化镓材料与铜组装如图的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4.以下说法错误的是( )
| A. | 铜电极表面的电极反应式 CO2+8e-+8H+=CH4+2H2O | |
| B. | 为提高该人工光合系统的工作效率,可向装置中加入少量硫酸 | |
| C. | 该装置仅将化学能转变为电能 | |
| D. | 装置中的H+由左向右移动 |
15.下列实验能获得成功的是( )
| A. | 向乙酸乙酯中加入足量的30%NaOH溶液,在加热的条件下观察酯层的消失 | |
| B. | 乙醇与浓硫酸混合,加热至140℃制取乙烯 | |
| C. | 向2mL的甲苯中加入3滴KMnO4酸性溶液,用力振荡,观察溶液颜色褪去 | |
| D. | 1 mol•L-1CuSO4溶液2 mL和0.5mol•L-1NaOH溶液2mL混合后加入40%的乙醛溶液0.5mL,加热煮沸观察砖红色沉淀的生成 |
2.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 滴入酚酞试液显红色的溶液中:K+、Na+、Cu2+、SO42- | |
| B. | 在$\frac{c({H}^{+})}{c(O{H}^{-})}$=10-12的溶液中:K+、Ba2+、Cl-、ClO- | |
| C. | 水电离产生的c(H+)=10-13mol•L-1 的溶液中:Na+、Cl-、NO3-、CH3COO- | |
| D. | pH=0的溶液中:Na+、NO3-、S2-、Cl- |
12.2012年1月16日在阿联酋首都阿布扎比举行的“2012年世界未来能源峰会”上,联合国秘书长潘基文启动联合国“人人享有可持续能源国际年”.下列不能体现“可持续”理念的是( )
| A. | 应用高效洁净的能源转换技术,推广使用节能环保材料 | |
| B. | 大力发展火力发电,解决电力紧张问题 | |
| C. | 研发以高纯硅为核心材料的光伏发电技术 | |
| D. | 大力开发新能源,如核能、太阳能、风能等,减少化石能源的使用 |
16.如果你家里的食用花生油中不小心混入了水,你将采用的分离方法是( )
| A. | 过滤 | B. | 分液 | C. | 萃取 | D. | 蒸馏 |
17.要防止水体污染,改善水质,最根本的措施是( )
| A. | 控制工业废水的排放 | B. | 控制生活污水的排放 | ||
| C. | 对被污水污染了的河流进行治理 | D. | 减少用水量 |