题目内容
15.下列实验能获得成功的是( )| A. | 向乙酸乙酯中加入足量的30%NaOH溶液,在加热的条件下观察酯层的消失 | |
| B. | 乙醇与浓硫酸混合,加热至140℃制取乙烯 | |
| C. | 向2mL的甲苯中加入3滴KMnO4酸性溶液,用力振荡,观察溶液颜色褪去 | |
| D. | 1 mol•L-1CuSO4溶液2 mL和0.5mol•L-1NaOH溶液2mL混合后加入40%的乙醛溶液0.5mL,加热煮沸观察砖红色沉淀的生成 |
分析 A.乙酸乙酯与氢氧化钠反应生成乙酸钠和乙醇;
B.制取乙烯,需要在170℃;
C.甲苯可与酸性高锰酸钾反应;
D.1mol•L-1CuSO4溶液2mL和0.5mol•L-1NaOH溶液4mL混合,碱不足.
解答 解:A.乙酸乙酯与氢氧化钠反应生成乙酸钠和乙醇,酯层消失,故A正确;
B.制取乙烯,需要在170℃乙醇发生消去反应,而加热至140℃生成乙醚,故B错误;
C.甲苯可与酸性高锰酸钾反应,酸性高锰酸钾褪色,故C正确;
D.1mol•L-1CuSO4溶液2mL和0.5mol•L-1NaOH溶液4mL混合,碱不足,不能检验乙醛中的-CHO,不生成砖红色沉淀,故D错误.
故选AC.
点评 本题考查化学实验方案的评价,为高频考点,涉及有机物的结构与性质、有机物的制取等,把握有机物性质及反应为解答的关键,注意实验的评价性分析,题目难度不大.

练习册系列答案
相关题目
6. a、b、c、d、e五种物质均含有一种相同的元素,在一定条件下可发生如图所示转化,其中a是单质,b在通常状况下是气体,c、d都是氧化物,e是该元素的最高价氧化物对应水化物,且是一种强电解质,则a可能是( )
a、b、c、d、e五种物质均含有一种相同的元素,在一定条件下可发生如图所示转化,其中a是单质,b在通常状况下是气体,c、d都是氧化物,e是该元素的最高价氧化物对应水化物,且是一种强电解质,则a可能是( )
 a、b、c、d、e五种物质均含有一种相同的元素,在一定条件下可发生如图所示转化,其中a是单质,b在通常状况下是气体,c、d都是氧化物,e是该元素的最高价氧化物对应水化物,且是一种强电解质,则a可能是( )
a、b、c、d、e五种物质均含有一种相同的元素,在一定条件下可发生如图所示转化,其中a是单质,b在通常状况下是气体,c、d都是氧化物,e是该元素的最高价氧化物对应水化物,且是一种强电解质,则a可能是( )| A. | C12 | B. | N2 | C. | S | D. | C |
10.下列说法正确的是( )
| A. | 常温下0.4 mol/L HB溶液与0.2 mol/L NaOH溶液等体积混合后溶液的pH=3,则混合溶液中离子浓度的大小顺序为:c (Na+)>c (B-)>c (H+)>c (OH-) | |
| B. | 常温时,pH均为2的CH3COOH溶液和HCl溶液,pH均为12的氨水和NaOH溶液,四种溶液中由水电离的c(H+)相等 | |
| C. | 常温下0.1 mol/L的下列溶液 ①NH4Al(SO4)2、②NH4Cl、③NH3•H2O、④CH3COONH4中c (NH$_4^+$)由大到小的顺序是:②>①>④>③ | |
| D. | 0.1 mol/L NaHB溶液中其pH为4:c(HB-)>c(H2B)>c(B$_{\;}^{2-}$) |
20.下列说法正确的是( )
| A. | 硫粉在过量的纯氧中燃烧可以生成SO3 | |
| B. | 可以用澄清石灰水鉴别SO2和CO2 | |
| C. | SO2能使酸性KMnO4水溶液褪色,是因为SO2有漂白性 | |
| D. | 铁粉与过量硫粉反应生成硫化亚铁 |
7.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压.高铁电池的总反应为:3Zn+2K2FeO4+8H2O$?_{充电}^{放电}$3Zn(OH)2+2Fe(OH)3+4KOH.下列叙述不正确的是( )
| A. | 放电时每转移3 mol电子,正极有1mol K2FeO4被氧化 | |
| B. | 充电时阳极反应为:Fe(OH)3-3e-+5OH-=FeO42-+4H2O | |
| C. | 放电时锌失去电子,发生氧化反应 | |
| D. | 放电时负极附近溶液的碱性降低 |
4.下列物质中,不属于电解质的是( )
| A. | NaOH | B. | H2SO4 | C. | BaSO4 | D. | NaCl溶液 |


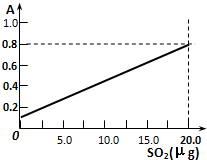 某省2005年工业(主要是热电厂)二氧化硫排放总量为1.24×106 t,全省酸雨污染比较严重.分析降雨成分发现,雨水中阴离子仍以硫酸根离子为主,约占阴离子总量的61.9%,阳离子以铵根离子为主,约占阳离子总量的84.1%.阴离子中SO42-和NO3-的质量比为4.13:1,NO3-的比例呈明显上升的趋势.回答下列问题:
某省2005年工业(主要是热电厂)二氧化硫排放总量为1.24×106 t,全省酸雨污染比较严重.分析降雨成分发现,雨水中阴离子仍以硫酸根离子为主,约占阴离子总量的61.9%,阳离子以铵根离子为主,约占阳离子总量的84.1%.阴离子中SO42-和NO3-的质量比为4.13:1,NO3-的比例呈明显上升的趋势.回答下列问题: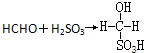
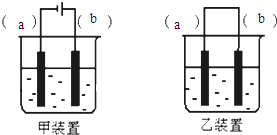 实验室用FeSO4溶液和NaOH溶液反应制取Fe(OH)2,却很难看到稳定的白色沉淀.有同学设计了一种新的实验方法,能清楚看到生成白色沉淀及白色沉淀转化成红褐色沉淀的现象.请完成以下空白:
实验室用FeSO4溶液和NaOH溶液反应制取Fe(OH)2,却很难看到稳定的白色沉淀.有同学设计了一种新的实验方法,能清楚看到生成白色沉淀及白色沉淀转化成红褐色沉淀的现象.请完成以下空白: