题目内容
3.某课外兴趣小组为了探究碱性溶液中Mg2+、AlO-与溶液pH的关系,进行下列实验:向含有0.1mol HCl、0.1mol MgCl2、1.0mol AlCl3的混合溶液中逐渐加入NaOH溶液,均至反应后溶液体积1L.测得部分实验数据如下表:| pH | 9 | 10 | 11 |
| c(Mg2+)/mol•L-1 | 10-1 | 10-3 | 10-5 |
| c(AlO2-)/mol•L-1 | 10-2 | 10-1 | 1 |
(1)向混合溶液中加入NaOH溶液至pH=9,能否有Mg(OH)2沉淀出现否(填“能”或“否”),由此你得到的初步结论是Mg2+在弱碱性溶液中不能生成沉淀或Mg(OH)2存在溶解平衡.
(2)向混合溶液中加入NaOH溶液至pH=10,需要NaOH溶液中有多少克NaOH?(最后结果保留两位小数)
分析 (1)当溶液的pH=9时,溶液中镁离子的浓度为0.1mol/L;
(2)pH=10时,溶液中c(Mg2+)=10-3mol/L,c(AlO2-)=0.1 mol/L.
故消耗NaOH溶液分为四个阶段:H++OH-=H2O、Mg2++2OH-=Mg(OH)2↓、Al(OH)3+OH-=AlO2-+2H2O、Al(OH)3 +OH-=AlO2-+2H2O.
根据溶液中的Mg2+的剩余量和AlO2-的生成量来计算需要的NaOH的物质的量和质量.
解答 解:(1)向含有0.1mol HCl、0.1mol MgCl2、1.0mol AlCl3的混合溶液中逐渐加入NaOH溶液,均至反应后溶液体积1L.此时溶液中的镁离子的浓度为0.1mol/L.而当溶液的pH=9时,溶液中镁离子的浓度为0.1mol/L,浓度没有减少,故无氢氧化镁沉淀生成,
故答案为:否;Mg2+在弱碱性溶液中不能生成沉淀或Mg(OH)2存在溶解平衡;
(2)pH=10时,溶液中c(Mg2+)=10-3mol/L,c(AlO2-)=0.1 mol/L,氢离子几乎被完全反应.
向混合溶液中加入NaOH溶液反应过程分为三个阶段:设氢离子消耗的NaOH 的物质的量为xmol,镁离子消耗的氢氧化钠为ymol,铝离子转化为氢氧化铝沉淀消耗的氢氧化钠为zmol,氢氧化铝溶解消耗的氢氧化钠为Qmol,则有:
H++OH-=H2O
1 1
0.1mol xmol
Mg2++2OH-=Mg(OH)2↓
1 2
0.099 mol ymol
Al3++3OH-=Al(OH)3↓
1 3
1mol zmol
Al(OH)3 +OH-=AlO2-+2H2O
1 1
0.1 mol Q mol
解得x=0.1mol
y=0.198mol
z=3mol
Q=0.1mol
则NaOH的质量为m=(0.1 mol+0.198 mol+3 mol+0.1 mol)×40 g/mol=135.92 g,
答:需要NaOH的质量为135.92 g.
点评 本题考查了根据化学方程式的有关计算,分析出向盐酸、氯化镁和氯化铝的混合溶液中加入NaOH的反应的先后顺序是关键,综合性较强,难度较大.

 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案| A. | 对甲基苯酚( )属于芳香烃 )属于芳香烃 | B. |  TNT TNT | ||
| C. |  2-乙基丁烷 2-乙基丁烷 | D. |  3-甲基-1-丁烯 3-甲基-1-丁烯 |

| A. | 图I所示的装置能将化学能转变为电能 | |
| B. | 图II所示的反应为吸热反应 | |
| C. | 中和反应中,反应物的总能量比生成物的总能量低 | |
| D. | 化学反应中能量变化的主要原因是化学键的断裂与生成 |
| A. | 钠的金属性比钾强,工业上用钠制取钾(Na+KCl $\frac{\underline{\;800℃\;}}{\;}$K↑+NaCl) | |
| B. | 利用Al2O3制作的坩埚,可用于熔融烧碱 | |
| C. | 氢氟酸具有强酸性,用氢氟酸蚀刻玻璃 | |
| D. | 制水泥和玻璃都用石灰石作原料 |
| A. | 20mL3mol/L 的 X 溶液 | B. | 20mL2mol/L 的 X 溶液 | ||
| C. | 10mL4mol/L 的 X 溶液 | D. | 10mL2mol/L 的 X 溶液 |

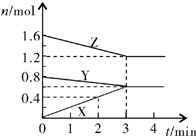 某温度时,在2L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化的曲线如图所示.由图中数据分析:
某温度时,在2L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化的曲线如图所示.由图中数据分析: