题目内容
下列叙述中,正确的是( )
A、稀释Na2CO3溶液时,
| ||||||
B、500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应,放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)
| ||||||
| C、相同条件下,2mol氢原子所具有的能量小于1mol氢分子所具有的能量 | ||||||
| D、常温下反应4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s)的△H<0,△S<0 |
考点:盐类水解的原理,热化学方程式,焓变和熵变
专题:
分析:A、稀释溶液离子浓度变化,平衡常数不变;
B、可逆反应不能完全进行到底;
C、氢原子转化为氢分子,形成化学键放出能量,可据此判断能量的大小;
D、该反应能自发进行,且△S<0,应满足△H-T?△S<0,以此进行判断.
B、可逆反应不能完全进行到底;
C、氢原子转化为氢分子,形成化学键放出能量,可据此判断能量的大小;
D、该反应能自发进行,且△S<0,应满足△H-T?△S<0,以此进行判断.
解答:
解:A、Na2CO3溶液中存在水解平衡:CO32-+H2O?HCO3-+OH-,反应平衡常数K=
,K只随温度变化,加水稀释平衡常数不变,故A错误;
B、0.5mol N2和1.5molH2置于密闭的容器中充分反应生成1molNH3(g),放热19.3kJ,因反应为可逆反应,则1molN2和3molH2置于密闭的容器中充分反应生成NH3(g)不是2mol,放热不是38.6kJ,则热化学反应方程式中的反应热数值错误,故B错误;
C、氢原子转化为氢分子,形成化学键放出能量,说明2mol氢原子的能量大于1molH2,故C错;
D、常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s)能自发进行,应满足△H-T?△S<0,该反应为熵减反应,即△S<0,说明是放热反应,△H<0,故D正确;
故选D.
| c(HCO3-)×c(OH-) |
| c(CO32-) |
B、0.5mol N2和1.5molH2置于密闭的容器中充分反应生成1molNH3(g),放热19.3kJ,因反应为可逆反应,则1molN2和3molH2置于密闭的容器中充分反应生成NH3(g)不是2mol,放热不是38.6kJ,则热化学反应方程式中的反应热数值错误,故B错误;
C、氢原子转化为氢分子,形成化学键放出能量,说明2mol氢原子的能量大于1molH2,故C错;
D、常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s)能自发进行,应满足△H-T?△S<0,该反应为熵减反应,即△S<0,说明是放热反应,△H<0,故D正确;
故选D.
点评:本题主要考查的是盐类水解原理、热化学反应方程式正误判断等,有一定的难度.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
低温脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:2NH3(g)+NO(g)+NO2(g)
2N2(g)+3H2O(g)△H<0在恒容的密闭容器中,下列有关说法正确的是( )
| 180℃ |
| 催化剂 |
| A、平衡时,其他条件不变,升高温度可使该反应的平衡常数增大 |
| B、平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小 |
| C、单位时间内消耗NO和N2的物质的量比为1:2时,反应达到平衡 |
| D、其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大 |
将W克氯化钠与碳酸氢钠的混合物溶于水,加入足量的氢氧化钡溶液充分反应过滤,称得W克沉淀物.则原混合中氯化钠的质量分数是( )
| A、28.6% |
| B、42.6% |
| C、41.2% |
| D、57.4% |
 某温度下,BaSO4在水中的沉淀溶解平衡曲线如图所示,下列说法正确的是( )
某温度下,BaSO4在水中的沉淀溶解平衡曲线如图所示,下列说法正确的是( )| A、加入Na2SO4可以使溶液由A点变到B点 |
| B、通过蒸发可以使溶液由D点变到C点 |
| C、D点无BaSO4沉淀生成 |
| D、A点对应的Ksp等于c点对应的Ksp |
A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X.它们有如下的转化关系(部分产物及反应条件已略去),下列判断正确的是( )
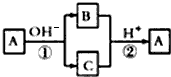

| A、X元素一定为非金属元素 |
| B、X元素可能为Al |
| C、反应①和②互为可逆反应 |
| D、反应①和②可能为氧化还原反应 |
 实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择.化工行业的发展必须符合国家节能减排的总体要求.试运用所学知识,解决下列问题:
实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择.化工行业的发展必须符合国家节能减排的总体要求.试运用所学知识,解决下列问题: