题目内容
12.写出下列物质的电离方程式:(1)Ba(OH)2:Ba(OH)2=Ba2++2OH-
(2)H2SO4:H2SO4=2H++SO42-
(3)NH3•H2O:NH3•H2O?NH4++OH-
(4)H2CO3:H2CO3?HCO3-+H+,HCO3-?H++CO32-
(5)NaHS:NaHS=Na++HS-,HS-?H++S2-
(6)NaHSO3:NaHSO3=Na++HSO3-,HSO3-?H++SO32-.
分析 用化学式和离子符号表示电离过程的式子,称为电离方程式,表示物质溶解于水时电离成离子的化学方程式;氢氧化钡是强碱完全电离,硫酸是强酸,完全电离,硫氢化钠、亚硫酸钠是盐,是强电解质完全电离,一水合氨、碳酸属于弱酸存在电离平衡,据此进行分析解答.
解答 解:(1)氢氧化钡是强电解质,是由氢氧根离子和钡离子构成,能完全电离,电离方程式为:Ba(OH)2=Ba2++2OH-,
故答案为:Ba(OH)2=Ba2++2OH-;
(2)硫酸是强电解质,能完全电离,电离方程式为:H2SO4=2H++SO42-,
故答案为:H2SO4=2H++SO42-;
(3)NH3•H2O是弱电解质部分电离,电离过程可逆,电离方程式为:NH3•H2O?NH4++OH-,
故答案为:NH3•H2O?NH4++OH-;
(4)H2CO3是弱酸为弱电解质,分步电离,电离过程可逆,电离方程式为:H2CO3?HCO3-+H+,HCO3-?H++CO32-,
故答案为:H2CO3?HCO3-+H+,HCO3-?H++CO32-;
(5)NaHS是强碱弱酸盐,属于强电解质完全电离,HS-离子部分电离,电离方程式为:NaHS=Na++HS-,HS-?H++S2-,
故答案为:NaHS=Na++HS-;HS-?H++S2-;
(6)NaHSO3是强碱弱酸盐,属于强电解质完全电离,HSO3-离子部分电离,电离方程式为:NaHSO3=Na++HSO3-,HSO3-?H++SO32-,
故答案为:NaHSO3=Na++HSO3-,HSO3-?H++SO32-..
点评 本题考查了电离方程式的书写,掌握电离方程式的书写方法并能灵活运用是正确解答此类题的关键,题目难度不大.

练习册系列答案
相关题目
2.油条是我国北方的传统食品,其做法是将明矾,碱,食盐按比例加入温水中,再加入面粉搅拌成面团,放置,使面团产生气体,形成孔洞,达到柔顺,放置过程发生反应:3Na2CO3+2KAl(SO4)2•12H2O═3Na2SO4+K2SO4+3CO2↑+2A1(OH)3↓+21H2O,下列有关判断正确的是( )
| A. | 从物质的分类角度来看,油条配方中的“明矾、碱”均属于盐 | |
| B. | 放置过程发生的反应为氧化还原反应 | |
| C. | 放置过程发生的反应中反应物和生成物均为电解质 | |
| D. | 反应的离子方程式为:3CO32-+2KAl(SO4)2•12H2O═3Na2SO4+2K++4SO42-+3CO2↑+2Al(OH)3↓+21 H2O |
3.下列反应中,被氧化与被还原的元素是同一元素的是( )
| A. | Cl2+2NaOH═NaCl+NaClO+H2O | B. | Fe+CuSO4═FeSO4+Cu | ||
| C. | 2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑ | D. | 3NO2+H2O=2HNO3+NO |
20.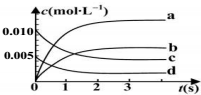 在2L密闭容器内,800℃时反应:2N0(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表:
在2L密闭容器内,800℃时反应:2N0(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表:
[转化率=(某反应物转化的物质的量/该反应物起始的总的物质的量)×100%]
(1)上述反应是(填“是”或“不是”)可逆反应,在第 5s时,NO的转化率为65%;
(2)图中表示 NO2变化曲线的是b;用 O2表示 0~2s内该反应的平均速率υ=0.0015mol/(L•s);
(3)能说明该反应已达到平衡状态的是BC(填字母序号).
A.υ(NO2)=2υ(O2)B.容器内压强保持不变
C.υ逆(NO)=2υ正(O2)D.容器内密度保持不变.
 在2L密闭容器内,800℃时反应:2N0(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表:
在2L密闭容器内,800℃时反应:2N0(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| N(NO)(mol) | 0.020 | 0.01 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)上述反应是(填“是”或“不是”)可逆反应,在第 5s时,NO的转化率为65%;
(2)图中表示 NO2变化曲线的是b;用 O2表示 0~2s内该反应的平均速率υ=0.0015mol/(L•s);
(3)能说明该反应已达到平衡状态的是BC(填字母序号).
A.υ(NO2)=2υ(O2)B.容器内压强保持不变
C.υ逆(NO)=2υ正(O2)D.容器内密度保持不变.
7. 为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题.
为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题.
(1)过氧化氢分解的化学方程式为2H2O2$\frac{\underline{\;氯化铁\;}}{\;}$2H2O+O2↑.
(2)实验①的目的是探究温度对H2O2分解速率的影响.
实验中滴加FeCl3溶液的目的是加快H2O2分解速率,使实验现象易于观察.
(3)实验②未观察到预期的实验现象,为了帮助该同学达到实验目的,你提出的对上述操作的改进意见是分别在两支试管中加入等量的FeCl3溶液(或将两支试管同时放入盛有相同温度热水的烧杯中)(用实验中所提供的几种试剂).
(4)某同学在50mL一定浓度的H2O2溶液中加入一定量的二氧化锰,放出气体的体积(标准状况下)与反应时间的关系如图所示,则A、B、C三点所表示的瞬时反应速率最慢的是C点的即时速率.
(5)对于H2O2分解反应,Cu2+也有一定的催化作用.为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验.请回答相关问题:

①定性分析:如图甲可通过观察,定性比较得出结论.有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是硫酸铁和硫酸铜阴离子相同,可以消除阴离子不同对实验的干扰.
②定量分析:用图乙所示装置做对照实验,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略.实验中需要测量的数据是产生40ml气体所需要的时间.
 为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题.
为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题.| 编号 | 操作 | 实验现象 |
| ① | 分别在试管A、B中加入5mL 5% H2O2溶液,各滴入2滴1mol/L FeCl3溶液.待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中浸泡;将试管B放入盛有40℃左右热水的烧杯中浸泡. | 试管A中不再产生气泡; 试管B中产生的气泡量增大. |
| ② | 另取两支试管分别加入5mL 5% H2O2溶液和5mL 10% H2O2溶液 | 试管A、B中均未明显见到有气泡产生. |
(2)实验①的目的是探究温度对H2O2分解速率的影响.
实验中滴加FeCl3溶液的目的是加快H2O2分解速率,使实验现象易于观察.
(3)实验②未观察到预期的实验现象,为了帮助该同学达到实验目的,你提出的对上述操作的改进意见是分别在两支试管中加入等量的FeCl3溶液(或将两支试管同时放入盛有相同温度热水的烧杯中)(用实验中所提供的几种试剂).
(4)某同学在50mL一定浓度的H2O2溶液中加入一定量的二氧化锰,放出气体的体积(标准状况下)与反应时间的关系如图所示,则A、B、C三点所表示的瞬时反应速率最慢的是C点的即时速率.
(5)对于H2O2分解反应,Cu2+也有一定的催化作用.为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验.请回答相关问题:

①定性分析:如图甲可通过观察,定性比较得出结论.有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是硫酸铁和硫酸铜阴离子相同,可以消除阴离子不同对实验的干扰.
②定量分析:用图乙所示装置做对照实验,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略.实验中需要测量的数据是产生40ml气体所需要的时间.
17.下列有关化学用语的理解错误的是( )
| A. |  表示丙烯的键线式 表示丙烯的键线式 | B. |  表示甲烷分子球棍模型 表示甲烷分子球棍模型 | ||
| C. | C2H4O2表示乙酸的分子式 | D. |  34S2-的结构示意图 34S2-的结构示意图 |