题目内容
10.下列叙述中,正确的是( )| A. | 不同的原子之间只能构成共价化合物 | |
| B. | 单质中不一定存在非极性键 | |
| C. | 非金属原子之间只能构成共价化合物 | |
| D. | Cl2的沸点比F2高,这与化学建的大小有关 |
分析 A.不同的原子之间可能构成单质;
B.单原子分子中不存在化学键,金属中存在金属键;
C.非金属原子之间可能构成单质;
D.分子晶体的熔沸点与其分子间作用力有关.
解答 解:A.不同的原子之间可能构成单质,如HD,故A错误;
B.单原子分子中不存在化学键,如稀有气体中不含化学键,金属中存在金属键,如Fe等金属单质,故B正确;
C.非金属原子之间可能构成单质,如氮气等,故C错误;
D.分子晶体的熔沸点与其分子间作用力有关,分子间作用力越大其熔沸点越高,与化学键无关,故D错误;
故选B.
点评 本题考查化学键与物质的关系、物质熔沸点高低影响因素等知识点,明确物质构成微粒及微粒之间作用力是解本题关键,易错选项是AD,注意化学键影响分子的稳定性不影响熔沸点,为易错点.

练习册系列答案
 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目
20.下列原子的价电子构型中,第一电离能最小的是( )
| A. | 2s22p4 | B. | 3s23p4 | C. | 4s24p4 | D. | 5s25p4 |
1.在常温常压下,取下列等质量4种气态烃,分别在足量的氧气中燃烧,其中消耗氧气最多的是( )
| A. | CH4 | B. | C2H6 | C. | C3H8 | D. | C4H10 |
18.甲烷分子中4个氢原子被苯基取代,可得如图所示分子,对该分子的描述正确的是( )


| A. | 此物质是苯的同系物 | B. | 所有碳原子可能在同一平面上 | ||
| C. | 此分子的一氯取代产物有3种 | D. | 此物质分子式为C25H22 |
15.已知短周期元素a、b、c、d、e的原子序数依次增大、其氢化物中a、b、c、d、e的化合价如表,下列说法不正确的是( )
| 元素 | a | b | c | d | e |
| 化合价 | -4 | +1 | -4 | -2 | -1 |
| A. | 元素a、c、d的最高价氧化物都属于酸性氧化物 | |
| B. | 元素c、d、e的氢化物稳定性和最高价氧化物对应水化物的酸性均依次增强 | |
| C. | 元素周期表中,元素c位于金属和非金属分界线附近,其单质常用作光电池材料 | |
| D. | 元素b、d、e的原子半径和离子半径均依次减小 |
7.下列有关对定量实验误差分析正确的是( )
| A. | 中和热测定实验中,缓慢地将NaOH溶液倒入测定装置中--测定结果无影响 | |
| B. | 酸碱中和滴定实验中,滴定前无气泡而滴定后有气泡_测定结果偏高 | |
| C. | 测定溶液pH的实验中,用干燥pH试纸测定新制氯水的pH--测定结果无影响 | |
| D. | 现需90mL 1.0mol•L-1NaOH溶液,称取3.6gNaOH固体配制--溶液浓度偏低 |

 .
. +CH3COOH$→_{△}^{浓H_{2}SO_{4}}$
+CH3COOH$→_{△}^{浓H_{2}SO_{4}}$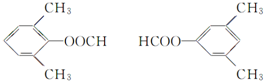 .
. 、④HCHO,其中碳原子采取sp2杂化的分子有①③④
、④HCHO,其中碳原子采取sp2杂化的分子有①③④