题目内容
在无土栽培中,需配制一种含 50mol NH4Cl、16mol KCl 和24mol K2SO4的营养液.若用KCl、NH4Cl和(NH4)2SO4三种固体为原料来配制,其物质的量分别为( )
| A、2mol、64mol、24mol |
| B、64mol、2mol、24mol |
| C、32mol、50mol、12mol |
| D、16mol、50mol、24mol |
考点:物质的量的相关计算
专题:计算题
分析:计算营养液中n(NH4+)、n(Cl-)、n(K+)、n(SO42-),根据离子守恒计算用KCl、NH4Cl和(NH4)SO4三种固体为原料来配制时需要各自物质的量.
解答:
解:含50molNH4Cl、16molKCl和24molK2SO4的营养液中:n(NH4+)=50mol,n(Cl-)=50mol+16mol=66mol,n(K+)=16mol+24mol×2=64mol,n(SO42-)=24mol,
由KCl、NH4Cl和(NH4)2SO4三种固体配制的营养液,营养液中各离子物质的量与含50molNH4Cl、16molKCl和24molK2SO4的营养液中相应离子物质的量相等,
根据硫酸根离子守恒可知,需要n[(NH4)2SO4]=24mol,
再由铵根离子守恒得n(NH4Cl)=50mol-24mol×2=2mol,
由氯离子守恒,则n(KCl)=66mol-2mol=64mol,
故选B.
由KCl、NH4Cl和(NH4)2SO4三种固体配制的营养液,营养液中各离子物质的量与含50molNH4Cl、16molKCl和24molK2SO4的营养液中相应离子物质的量相等,
根据硫酸根离子守恒可知,需要n[(NH4)2SO4]=24mol,
再由铵根离子守恒得n(NH4Cl)=50mol-24mol×2=2mol,
由氯离子守恒,则n(KCl)=66mol-2mol=64mol,
故选B.
点评:本题考查物质的量的有关计算,侧重于学生的分析能力和计算能力的考查,难度不大,注意利用离子守恒进行的计算.

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案
相关题目
下列各项表达中正确的是( )
A、Na2O2的电子式为 |
| B、二氧化硅的分子式为SiO2 |
C、氦原子的电子排布图为  |
D、Cl-的结构示意图为 |
 原子结构模型的演变图中,(1)为道尔顿实心球式原子模型、(2)为卢瑟福带核的原子模型、(3)为汤姆生葡萄干面包式原子模型、(4)为玻尔轨道式原子模型.其中符合历史演变顺序的一组排列是( )
原子结构模型的演变图中,(1)为道尔顿实心球式原子模型、(2)为卢瑟福带核的原子模型、(3)为汤姆生葡萄干面包式原子模型、(4)为玻尔轨道式原子模型.其中符合历史演变顺序的一组排列是( )| A、(1)(3)(2)(4) |
| B、(1)(2)(3)(4) |
| C、(1)(4)(3)(2) |
| D、(1)(3)(4)(2) |
容量瓶上未必有固定的( )
| A、溶液浓度 | B、容量 |
| C、定容刻度 | D、配制温度 |
下列说法正确的是( )
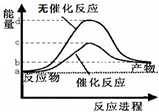

| A、根据如图知该反应有催化剂和无催化剂的活化能相差d-c,但其反应热均为a-b | ||
| B、若2C(s)+O2(g)=2CO(g)△H=-221.0 kJ/mol,则碳的燃烧热为110.5kJ/mol | ||
| C、需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应 | ||
| D、已知:Ⅰ:对于反应:3Si(s)+2N2(g)=Si3N4(s)△H=-a kJ/mol,Ⅱ:N≡N键能为bkJ?mol-1Si-Si键能为ckJ?mol-1 且a、b、c均大于零,则断开1 mol Si-N键所需的能量为
|
下列关于化学键的叙述不正确的是( )
| A、离子化合物一定含有离子键 |
| B、共价键只存在于共价化合物中 |
| C、化学键的形成与成键原子结构有关,主要通过原子之间价电子的得失或共用来实现 |
| D、化学反应的本质是旧键断裂,新键形成 |
有一分子式为C8H14N2O5的二肽,经水解得丙氨酸和氨基酸X,则X分子组成可能是( )
| A、C3H7NO3 |
| B、C5H9NO4 |
| C、C5H11NO5 |
| D、C5H7NO4 |
 在一个体积为1L的密闭容器中发生某化学反应:2A(g)?B(g)+C(g),三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在950℃,B、C的起始浓度都为0,反应物A的浓度(mol?L-1)随时间(min)的变化如图所示.试回答下列问题:
在一个体积为1L的密闭容器中发生某化学反应:2A(g)?B(g)+C(g),三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在950℃,B、C的起始浓度都为0,反应物A的浓度(mol?L-1)随时间(min)的变化如图所示.试回答下列问题: