题目内容
氢是宇宙中最丰富的元素,为一切元素之.
(1)H原子的电子排布式是“1s1”,该式子未表明电子运动状态的方面是 (选填编号).
a.电子层 b.电子亚层 c.电子云的伸展方向 d.电子的自旋
(2)金属锂与氢气在一定条件下能直接化合生成 LiH,以下事实能说明LiH是离子化合物的是 (选填编号).
a.H为-1价 b.熔融状态能导电 c.加热到600℃不分解
LiH的电子式为 .核外有2个电子的简单阴、阳离子有若干种,试比较它们半径的大小 .
(3)非金属元素R的气态氢化物的化学式为H8-nR,则R的最高氧化物的化学式为 .
(4)根据表中的键能数据,写出氮气、氢气合成氨气的热化学方程式 .在合成氨的工业生产中,科学家在努力寻找活性温度更低的新催化剂,简述其意义 .
(5)钯(Pd)是优良的储氢金属:2Pd (s)+xH2(g)?2PdHx (s)+Q(Q>0)通常状况下,x的最大值为0.8,为使x>0.8可采取的措施是 ;为使PdHx 产生H原子并在固体中快速流动,可采取的措施是 (选填编号).
a.升温 b.减压 c.及时移走金属钯.
(1)H原子的电子排布式是“1s1”,该式子未表明电子运动状态的方面是
a.电子层 b.电子亚层 c.电子云的伸展方向 d.电子的自旋
(2)金属锂与氢气在一定条件下能直接化合生成 LiH,以下事实能说明LiH是离子化合物的是
a.H为-1价 b.熔融状态能导电 c.加热到600℃不分解
LiH的电子式为
(3)非金属元素R的气态氢化物的化学式为H8-nR,则R的最高氧化物的化学式为
| 共价键 | 键能(KJ/mol) |
| N≡N | 946 |
| H-H | 436 |
| H-N | 391 |
(5)钯(Pd)是优良的储氢金属:2Pd (s)+xH2(g)?2PdHx (s)+Q(Q>0)通常状况下,x的最大值为0.8,为使x>0.8可采取的措施是
a.升温 b.减压 c.及时移走金属钯.
考点:化学平衡的影响因素,电子式,原子核外电子的运动状态,离子化合物的结构特征与性质,热化学方程式
专题:
分析:(1)据“1s1”可知该电子所在的电子层、电子亚层、电子云的伸展方向;
(2)离化合物在熔融状态下可以导电;相同电子数的粒子,质子数越多,微粒半径越小;
(3)据其化合价确定其化学式;
(4)据△H=反应物键能和-生成物键能和求出其焓变,在书写热化学方程式;
(5)该反应为正反应气体体积减小的放热反应,只要改变外界条件使平衡正向移动即可.
(2)离化合物在熔融状态下可以导电;相同电子数的粒子,质子数越多,微粒半径越小;
(3)据其化合价确定其化学式;
(4)据△H=反应物键能和-生成物键能和求出其焓变,在书写热化学方程式;
(5)该反应为正反应气体体积减小的放热反应,只要改变外界条件使平衡正向移动即可.
解答:
解:(1)据“1s1”可知该电子所在的电子层、电子亚层、电子云的伸展方向,故答案为:d;
(2)离化合物在熔融状态下可以导电;LiH是离子化合物,据离子化合物电子式书写方法书写即可的其电子式为:Li+[:H]-;核外电子有2个的微粒有H-、Li、Be2+,相同电子数的粒子,质子数越多,微粒半径越小,所以其半径由大到小的顺序为:H->Li>Be2+,故答案为:b;Li+[:H]-;H->Li>Be2+;
(3)在H8-nR中,R的最低负价为-(8-n)所以其最高正价为8-(8-n)=n,所以其氧化物化学式为R2On 或ROn/2,故答案为:R2On 或ROn/2;
(4)△H=反应物键能和-生成物键能和=946KJ/mol+3×436KJ/mol-6×391KJ/mol=-92KJ/mol,所以其热化学方程式为:N2(g)+3H2(g)?2 NH3(g)△H=-92KJ/mol;催化剂能够降低反应的活化能,降低能耗,故答案为:N2(g)+3H2(g)?2 NH3(g)△H=-92KJ/mol;降低能耗;
(5)该反应为正反应气体体积减小的放热反应,只要改变外界条件使平衡正向移动即可使x>0.8,可以通过降低温度或加压;为使PdHx 产生H原子并在固体中快速流动,可以采取升温的方法,故答案为:降温、增压;a.
(2)离化合物在熔融状态下可以导电;LiH是离子化合物,据离子化合物电子式书写方法书写即可的其电子式为:Li+[:H]-;核外电子有2个的微粒有H-、Li、Be2+,相同电子数的粒子,质子数越多,微粒半径越小,所以其半径由大到小的顺序为:H->Li>Be2+,故答案为:b;Li+[:H]-;H->Li>Be2+;
(3)在H8-nR中,R的最低负价为-(8-n)所以其最高正价为8-(8-n)=n,所以其氧化物化学式为R2On 或ROn/2,故答案为:R2On 或ROn/2;
(4)△H=反应物键能和-生成物键能和=946KJ/mol+3×436KJ/mol-6×391KJ/mol=-92KJ/mol,所以其热化学方程式为:N2(g)+3H2(g)?2 NH3(g)△H=-92KJ/mol;催化剂能够降低反应的活化能,降低能耗,故答案为:N2(g)+3H2(g)?2 NH3(g)△H=-92KJ/mol;降低能耗;
(5)该反应为正反应气体体积减小的放热反应,只要改变外界条件使平衡正向移动即可使x>0.8,可以通过降低温度或加压;为使PdHx 产生H原子并在固体中快速流动,可以采取升温的方法,故答案为:降温、增压;a.
点评:本题考查了原子核外电子的排布及运动、化学式书写、粒子半径大小的比较、平衡移动,题目难度较大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列仪器能用酒精灯直接加热的是( )
| A、烧瓶 | B、容量瓶 | C、试管 | D、烧瓶 |
下列物质能通过单质直接化合反应制得的是( )
| A、FeCl2 |
| B、CuS |
| C、AlCl3 |
| D、Fe(OH)3 |
硅单质及其化合物在材料领域中一直扮演着主要角色.下列叙述中,不正确的是( )
| A、硅酸钠是制备木材防火剂的原料 |
| B、硅单质可用来制造太阳能电池 |
| C、硅单质是制造玻璃的主要原料 |
| D、二氧化硅是制造光导纤维的材料 |
在常温常压下的各组气体中,不能共存的是( )
| A、O2与N2 |
| B、NH3与O2 |
| C、SO2与O2 |
| D、HCl与NH3 |
 向盛有氯气的集气瓶中,注入约五分之一的下列液体并轻轻振荡,观察到的现象记录如图所示,判断瓶中注入的液体是( )
向盛有氯气的集气瓶中,注入约五分之一的下列液体并轻轻振荡,观察到的现象记录如图所示,判断瓶中注入的液体是( )| A、AgNO3溶液 |
| B、NaOH溶液 |
| C、水 |
| D、FeCl2溶液 |
 116号元素已被命名为“鉝”;2014年5月,科学家已确认发现117号元素,未命名,元素符号Uus;若将元素周期表的“一列”看作“一族”;则对117号元素的相关表述或性质推断错误的是( )
116号元素已被命名为“鉝”;2014年5月,科学家已确认发现117号元素,未命名,元素符号Uus;若将元素周期表的“一列”看作“一族”;则对117号元素的相关表述或性质推断错误的是( )| A、属第17族元素 |
| B、属卤族元素 |
| C、属非金属元素 |
| D、有放射性 |
某有机物蒸气完全燃烧需三倍于其体积的氧气,产生于二倍于其体积的二氧化碳(体积均在相同状况下测定),该有机物可能是( )
| A、C3H7OH |
| B、CH3CHO |
| C、CH3CO CH3 |
| D、C2H4 |
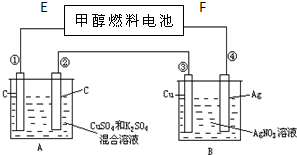 如图所示,用甲醇和氧气以及强碱做电解质溶液的新型燃料电池做电源,对A、B 装置通电一段时间后,发现有1.6g甲醇参加反应且③电极增重(假设工作时无能量损失).请回答下列问题:
如图所示,用甲醇和氧气以及强碱做电解质溶液的新型燃料电池做电源,对A、B 装置通电一段时间后,发现有1.6g甲醇参加反应且③电极增重(假设工作时无能量损失).请回答下列问题: