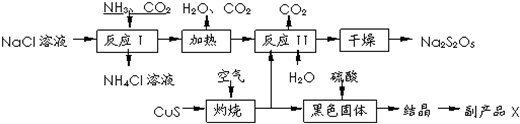
题目内容
17.下列事实不能用勒夏特列原理解释的是( )| A. | 实验室制乙酸乙酯时,不断的蒸出乙酸乙酯来提高产率 | |
| B. | CO有毒,会与血液中血红蛋白(用Hb表示)化合发生下述反应:CO+HbO2?HbCO+O2,输氧抢救CO中毒的患者 | |
| C. | 皂化反应采用强碱性条件,促使油脂水解 | |
| D. | 合成氨时,采用高温与高压来提高氨气的产率 |
分析 A.实验室制乙酸乙酯的反应为可逆反应,减少生成物浓度导致平衡向正反应方向移动;
B.增大生成物浓度,平衡向逆反应方向移动;
C.皂化反应是可逆反应,碱和油脂水解生成的羧酸发生中和反应而促进油脂水解;
D.合成氨反应是反应前后气体体积减小的放热反应,升高温度平衡逆向移动,增大压强平衡正向移动.
解答 解:A.实验室制乙酸乙酯的反应为可逆反应,减少生成物浓度导致平衡向正反应方向移动,从而提高乙酸乙酯产率,可以用平衡移动原理解释,故A不选;
B.增大生成物浓度,平衡向逆反应方向移动,从而减轻CO中毒现象,可以用平衡移动原理解释,故B不选;
C.皂化反应是可逆反应,碱和油脂水解生成的羧酸发生中和反应而促进油脂水解,可以采用平衡移动原理解释,故C不选;
D.合成氨反应是反应前后气体体积减小的放热反应,升高温度平衡逆向移动,不利于提高氨气产率,升高温度是为了加快反应速率,所以不能用平衡移动原理解释,故D选;
故选D.
点评 本题考查化学平衡移动原理,为高频考点,明确化学平衡移动原理适用范围是解本题关键,只有改变条件时能引起平衡移动的可逆反应才能用平衡移动原理解释,易错选项是D.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
7.下列属于正确的电离方程式是( )
| A. | HCO3-+H2O?CO32-+H3O+ | B. | NH4++H2O?NH3•H2O+H+ | ||
| C. | NaHCO3?Na++HCO3- | D. | H2S?2H++S2- |
8.能说明NH3分子的空间构型是三角锥形而不是平面正三角形的充分理由是( )
| A. | NH3与H+反应生成的NH4为正四面体结构 | |
| B. | NH3分子内3个共价键的键角、键长相等 | |
| C. | NH3分子内3个共价键的键长相等,3个键角都等于107° | |
| D. | NH3分子内3个共价键的键长相等,3个键角都等于120° |
5.在一定条件下,向一体积为2L的恒容密闭容器中充入2mol A、1mol B,发生反应:2A(g)+B(g)?3C(g)△H=-Q kJ/mol(Q>0).经过60s达到平衡,测得B的物质的量为0.4mol,下列对该平衡的叙述正确的是( )
| A. | 用C表示该反应的速率为0.03mol/(L•s) | |
| B. | 达到平衡,测得放出热量为x kJ,则x=Q | |
| C. | 若向容器中再充入1 mol C,重新达到平衡,A的体积分数保持不变 | |
| D. | 若升高温度,则V(逆)增大,V(正)减小,平衡逆向移动 |
12. 酸碱中和反应是中学化学一类重要的反应,某学生实验小组对课本中的两个酸碱中和实验进行了研究.
酸碱中和反应是中学化学一类重要的反应,某学生实验小组对课本中的两个酸碱中和实验进行了研究.
(1)用图甲装置进行强酸(50mL 0.5mol/L的HCl)和强碱(50mL 0.55mol/L的NaOH)反应的中和热测定.
①从实验装置上看,图中尚缺少的一种玻璃仪器是环形玻璃搅拌器.
②大小烧杯之间填满纸屑的作用是保温、隔热、减少实验过程中的热量散失.
③若用醋酸代替上述盐酸实验,实验测得的中和热的数值偏低(填“偏高”、“偏低”或“无影响”).
(2)用实验室准确配制的0.100mol/L的NaOH溶液测定某未知浓度的稀盐酸.其具体实验步骤如下:
①应选择b滴定管(填写图乙中对应字母),用少量标准NaOH溶液润洗2~3次水洗后的该滴定管,再加入标准的0.100mol/L的NaOH溶液并记录液面刻度读数;
②用酸式滴定管精确的放出25.00mL待测盐酸,置于用蒸馏水洗净的锥形瓶中.再加入2滴酚酞试液;
③滴定时,边滴边振荡,同时眼睛注视锥形瓶内溶液颜色的变化,观察到锥形瓶中溶液的颜色由无色变为浅红色,且半分钟不褪色即达到滴定终点;
④记录液面刻度读数.根据滴定管的两次读数得出消耗标准NaOH溶液的体积,再重复测定两次,实验结果记录见下表:
测得未知稀盐酸的物质的量浓度为0.096mol/L(保留小数点后3位).
 酸碱中和反应是中学化学一类重要的反应,某学生实验小组对课本中的两个酸碱中和实验进行了研究.
酸碱中和反应是中学化学一类重要的反应,某学生实验小组对课本中的两个酸碱中和实验进行了研究.(1)用图甲装置进行强酸(50mL 0.5mol/L的HCl)和强碱(50mL 0.55mol/L的NaOH)反应的中和热测定.
①从实验装置上看,图中尚缺少的一种玻璃仪器是环形玻璃搅拌器.
②大小烧杯之间填满纸屑的作用是保温、隔热、减少实验过程中的热量散失.
③若用醋酸代替上述盐酸实验,实验测得的中和热的数值偏低(填“偏高”、“偏低”或“无影响”).
(2)用实验室准确配制的0.100mol/L的NaOH溶液测定某未知浓度的稀盐酸.其具体实验步骤如下:
①应选择b滴定管(填写图乙中对应字母),用少量标准NaOH溶液润洗2~3次水洗后的该滴定管,再加入标准的0.100mol/L的NaOH溶液并记录液面刻度读数;
②用酸式滴定管精确的放出25.00mL待测盐酸,置于用蒸馏水洗净的锥形瓶中.再加入2滴酚酞试液;
③滴定时,边滴边振荡,同时眼睛注视锥形瓶内溶液颜色的变化,观察到锥形瓶中溶液的颜色由无色变为浅红色,且半分钟不褪色即达到滴定终点;
④记录液面刻度读数.根据滴定管的两次读数得出消耗标准NaOH溶液的体积,再重复测定两次,实验结果记录见下表:
| 实验次数 | 起始滴定管读数 | 终点滴定管读数 |
| 1 | 0.00mL | 24.02mL |
| 2 | 0.50mL | 24.46mL |
| 3 | 2.50mL | 25.02mL |
8.某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率.请回答下列问题:
(1)上述实验中发生反应的化学方程式有CuSO4+Zn=ZnSO4+Cu、Zn+H2SO4=ZnSO4+H2↑.
(2)加入硫酸铜溶液后可以加快氢气生成速率的原因是CuSO4与Zn反应产生的Cu与Zn形成Cu-Zn原电池,加快了氢气生成的速率.
(3)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与上述实验中CuSO4溶液起相似作用的是Ag2SO4.
(4)要加快上述实验中氢气生成速率,还可采取的措施有升温;增加H2SO4浓度 (答两种即可).
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如表一系列的实验:将表中所给的混合溶液分别加入到6个盛有过量Zn粒的容器中,收集产生的气体,记录获得相同体积的气体所需时间.
①请完成此实验设计,其中:V1=30,V6=10.
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因当加入一定量的CuSO4后,生成的单质Cu会沉积在Zn的表面,降低了Zn与H2SO4溶液的接触面积.
(1)上述实验中发生反应的化学方程式有CuSO4+Zn=ZnSO4+Cu、Zn+H2SO4=ZnSO4+H2↑.
(2)加入硫酸铜溶液后可以加快氢气生成速率的原因是CuSO4与Zn反应产生的Cu与Zn形成Cu-Zn原电池,加快了氢气生成的速率.
(3)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与上述实验中CuSO4溶液起相似作用的是Ag2SO4.
(4)要加快上述实验中氢气生成速率,还可采取的措施有升温;增加H2SO4浓度 (答两种即可).
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如表一系列的实验:将表中所给的混合溶液分别加入到6个盛有过量Zn粒的容器中,收集产生的气体,记录获得相同体积的气体所需时间.
实验 混合溶液 | A | B | C | D | E | F |
| 4mol/L H2SO4(mL) | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液(mL) | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O(mL) | V7 | V8 | V9 | V10 | 10 | 0 |
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因当加入一定量的CuSO4后,生成的单质Cu会沉积在Zn的表面,降低了Zn与H2SO4溶液的接触面积.
5.根据要求完成下列各小题实验.(a、b为弹簧夹,加热及固定装置已略去)
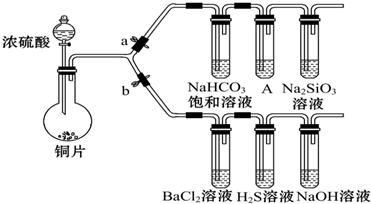
(1)验证SO2的氧化性、还原性和酸性氧化物的通性.
①若大量的SO2通入NaOH溶液中,其离子方程式是:SO2+NaOH═NaHSO3
②打开b,关闭a.能验证SO2具有氧化性的化学方程式是:2H2S+SO2═3S↓+2H2O.
③BaCl2溶液中无沉淀现象,将其分成两份,分别滴加下列溶液,将产生的沉淀的化学式填入下表相应位置.
写出其中SO2显示还原性并生成沉淀的离子方程式Ba2++SO2+Cl2+2H2O═BaSO4↓+4H++2Cl-.
(2)验证碳、硅非金属性的相对强弱.(已知酸性:亚硫酸>碳酸)
①铜与浓硫酸反应的化学方程式是Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,装置A中的试剂是酸性KMnO4溶液.
②连接仪器、检验装置的气密性、加药品后,打开a关闭b,然后滴入浓硫酸,加热.
③能说明碳的非金属性比硅强的实验现象是:A中酸性KMnO4溶液不退色,Na2SiO3溶液中出现白色沉淀.

(1)验证SO2的氧化性、还原性和酸性氧化物的通性.
①若大量的SO2通入NaOH溶液中,其离子方程式是:SO2+NaOH═NaHSO3
②打开b,关闭a.能验证SO2具有氧化性的化学方程式是:2H2S+SO2═3S↓+2H2O.
③BaCl2溶液中无沉淀现象,将其分成两份,分别滴加下列溶液,将产生的沉淀的化学式填入下表相应位置.
| 滴加的溶液 | 氯水 | 氨水 |
| 沉淀的化学式 |
(2)验证碳、硅非金属性的相对强弱.(已知酸性:亚硫酸>碳酸)
①铜与浓硫酸反应的化学方程式是Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,装置A中的试剂是酸性KMnO4溶液.
②连接仪器、检验装置的气密性、加药品后,打开a关闭b,然后滴入浓硫酸,加热.
③能说明碳的非金属性比硅强的实验现象是:A中酸性KMnO4溶液不退色,Na2SiO3溶液中出现白色沉淀.
6.关于胡椒酚(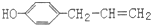 ,植物挥发油中成分)说法正确的是( )
,植物挥发油中成分)说法正确的是( )
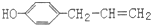 ,植物挥发油中成分)说法正确的是( )
,植物挥发油中成分)说法正确的是( )| A. | 该化合物属于芳香烃 | |
| B. | 分子中9个碳原子一定处于同一平面 | |
| C. | 它的部分同分异构体能够发生银镜反应 | |
| D. | 1 mol该有机物最多可与2 mol Br2 发生反应 |