题目内容
5.在一定条件下,向一体积为2L的恒容密闭容器中充入2mol A、1mol B,发生反应:2A(g)+B(g)?3C(g)△H=-Q kJ/mol(Q>0).经过60s达到平衡,测得B的物质的量为0.4mol,下列对该平衡的叙述正确的是( )| A. | 用C表示该反应的速率为0.03mol/(L•s) | |
| B. | 达到平衡,测得放出热量为x kJ,则x=Q | |
| C. | 若向容器中再充入1 mol C,重新达到平衡,A的体积分数保持不变 | |
| D. | 若升高温度,则V(逆)增大,V(正)减小,平衡逆向移动 |
分析 依据化学平衡三段式列式计算;
2A(g)+B(g)═3C(g);
起始量(mol) 2 1 0
变化量(mol) 1.2 0.6 1.8
平衡量(mol) 0.8 0.4 1.8
A、依据反应速率V=$\frac{△c}{△t}$计算分析;
B、反应是可逆反应,不能进行彻底;
C、若向容器再充入1mol C,压强增大,重新达到平衡,与原平衡是等效平衡;
D、升高温度正逆反应均增大.
解答 解:依据化学平衡三段式列式计算;
2A(g)+B(g)═3C(g);
起始量(mol) 2 1 0
变化量(mol) 1.2 0.6 1.8
平衡量(mol) 0.8 0.4 1.8
A、C的反应速率V=$\frac{△c}{△t}$=$\frac{\frac{1.8mol}{2L}}{60s}$=0.015mol/L•min,故A错误;
B、反应是可逆反应,不能进行彻底,所以达到平衡,测得放出热量为x kJ,则x<Q,故B错误;
C、若向容器再充入1mol C,压强增大,重新达到平衡,与原平衡是等效平衡,所以A的体积分数保持不变,故C正确;
D、升高温度正逆反应均增大,即V(逆)、V(正)增大,平衡逆向移动,故D错误.
故选C.
点评 本题考查了化学平衡影响因素的分析判断,注意反应前后气体体积的变化,掌握基础和平衡移动原理是关键,题目难度中等,注意把握三段式在化学平衡计算中的应用方法.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
15.如图是某燃煤发电厂处理废气的装置示意图.下列说法正确的是( )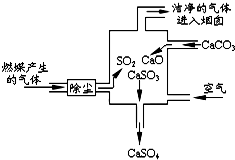

| A. | 此过程中没有分解反应 | |
| B. | 整个过程的反应可表示为:2SO2+2CaCO3+O2═2CaSO4+2CO2 | |
| C. | 使用此废气处理装置可减少CO2的排放 | |
| D. | 此过程中S元素的化合价未发生改变 |
16.用惰性电解电解饱和食盐水时,阴极发生的离子反应方程式为( )
| A. | 2H++2e→H2↑ | B. | 2H20+2C1-→H2↑+C12↑+20H- | ||
| C. | 2Cl--2e→Cl2↑ | D. | 2H20+2NaCl→H2↑+Cl2↑+2Na0H |
13.1mol铁铜混合物中,加入一定量的稀硝酸,下列对溶液中最终存在的离子的判断中正确的是( )
| A. | 可能含有Fe2+和Fe3+ | B. | 可能含有Fe2+和Cu2+ | ||
| C. | 可能含有Cu2+和Fe3+ | D. | 可能含有单质铜和Fe3+ |
20.下列事实不能说明醋酸属于弱电解质的是( )
| A. | 0.1 mol/L CH3COONa溶液显碱性 | |
| B. | 0.1 mol/L醋酸溶液的pH=3 | |
| C. | 物质的量浓度相同的盐酸和醋酸同时与锌反应,开始时锌粒跟盐酸反应比跟醋酸反应的速率快 | |
| D. | 中和100 ml 1 mol/L 的CH3COOH溶液需要100 ml 1 mol/L的NaOH溶液 |
10. 已知25℃时部分弱电解质的电离平衡常数数据如表所示:
已知25℃时部分弱电解质的电离平衡常数数据如表所示:
回答下列问题:
(1)物质的量浓度均为0.1mol•L-1的四种溶液:a.Na2CO3 b.NaHCO3 c.NaClO d.CH3COONa.它们的pH由大到小排列的顺序是a>c>b>d (填编号).
(2)常温下,0.1mol•L-1CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是BC.
A.c(H+) B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$
C.$\frac{c(O{H}^{-})}{c({H}^{+})}$ D.c(H+)•$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$
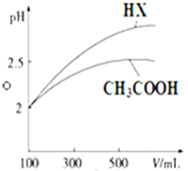
(3)CH3COOH与一元酸HX的溶液均为100mL、pH=2,加水稀释过程中pH与溶液体积的关系如图所示,则同温度时CH3COOH的电离平衡常数小于(填“大于”、“小于”或“等于”) HX的电离平衡常数.
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=9.9×10-7 mol•L-1(保留两位有效数字).
 已知25℃时部分弱电解质的电离平衡常数数据如表所示:
已知25℃时部分弱电解质的电离平衡常数数据如表所示:| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平衡常数 | Ka=1.8×10-5 | Kal=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
(1)物质的量浓度均为0.1mol•L-1的四种溶液:a.Na2CO3 b.NaHCO3 c.NaClO d.CH3COONa.它们的pH由大到小排列的顺序是a>c>b>d (填编号).
(2)常温下,0.1mol•L-1CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是BC.
A.c(H+) B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$
C.$\frac{c(O{H}^{-})}{c({H}^{+})}$ D.c(H+)•$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$
(3)CH3COOH与一元酸HX的溶液均为100mL、pH=2,加水稀释过程中pH与溶液体积的关系如图所示,则同温度时CH3COOH的电离平衡常数小于(填“大于”、“小于”或“等于”) HX的电离平衡常数.
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=9.9×10-7 mol•L-1(保留两位有效数字).
17.下列事实不能用勒夏特列原理解释的是( )
| A. | 实验室制乙酸乙酯时,不断的蒸出乙酸乙酯来提高产率 | |
| B. | CO有毒,会与血液中血红蛋白(用Hb表示)化合发生下述反应:CO+HbO2?HbCO+O2,输氧抢救CO中毒的患者 | |
| C. | 皂化反应采用强碱性条件,促使油脂水解 | |
| D. | 合成氨时,采用高温与高压来提高氨气的产率 |
14.已知反应2SO2(g)+O2(g)?2SO3(g)△H=-198kJ•mol-1,向某体积恒定的密闭容器中充入1mol SO2和0.5molO2,在一定条件下发生反应,下图是某物理量(Y)随时间(t)变化的示意图,下列说法正确的是( )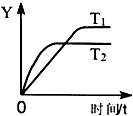

| A. | 温度T2<T1 | |
| B. | 反应达到平衡后放出99kJ的热量 | |
| C. | Y可能是SO2的转化率或SO3的浓度 | |
| D. | 反应达到平衡后容器内气体的密度减小 |
 汽车作为一种现代交通工具正在进入千家万户,汽车尾气中含有CO、NO2等有毒气体,其污染问题也成为当今社会急需解决的问题.
汽车作为一种现代交通工具正在进入千家万户,汽车尾气中含有CO、NO2等有毒气体,其污染问题也成为当今社会急需解决的问题.