题目内容
15.某废水中可能含有下列离子中的若干种:Al3+、Fe2+、Cu2+、Cl-、CO32-、NO3-、SO42-、SiO32-.现进行如下实验:a.取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色
b.向a所得溶液中加入BaCl2溶液,有白色沉淀生成
c.向a所得溶液中加入过量浓氨水,仅有红褐色沉淀生成,过滤,在所得溶液中加入盐酸至酸性时,再加入氢氧化钠溶液,有蓝色沉淀生成
已知:Cu(OH)2+4NH3•H2O=Cu(NH3)42++2OH-
请回答下列问题:
(1)该废水中一定含有的离子是Fe2+、Cu2+、NO3-、SO42-;
(2)实验a中加入盐酸生成无色气体的离子方程式是3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;
(3)实验c中加入盐酸至酸性的离子方程式是Cu(NH3)42++4H+=Cu2++4NH4+;
(4)过滤除去c中的蓝色沉淀,调整溶液的pH为10.7左右时,加入铝粉,反应产生氨气和氮气的体积比为1:4,其离子方程式为:Al+NO3-+OH-→AlO2-+NH3↑+N2↑+H2O(未配平).若除去0.2molNO3-,消耗铝9.6g.
分析 a.取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,说明气体为NO,则一定含有Fe2+、NO3-,则不含CO32-、SiO32-;
b.向a所得溶液中加入BaCl2溶液,有白色沉淀生成,应生成硫酸钡,则含有SO42-;
c.向a所得溶液中加入过量浓氨水,仅有红褐色沉淀生成,过滤,在所得溶液中加入盐酸至酸性时,再加入氢氧化钠溶液,有蓝色沉淀生成,说明生成氢氧化铜,则含有Cu2+,以此解答该题.
解答 解:(1)由以上分析可知该废水一定含有的离子是Fe2+、Cu2+、NO3-、SO42-,
故答案为:Fe2+、Cu2+、NO3-、SO42-;
(2)取溶液加入盐酸,有无色气体生成,该无色气体遇空气变成红棕色,说明是一氧化氮氧化为二氧化氮,则硝酸与亚铁离子反应生成NO和三价铁离子、水,其离子方程式为3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,
故答案为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;
(3)由题意可知溶液中存在Cu(NH3)42+,加入酸生成Cu2+,反应的离子方程式为Cu(NH3)42++4H+=Cu2++4NH4+,
故答案为:Cu(NH3)42++4H+=Cu2++4NH4+;
(4)反应产生氨气和氮气的体积比为1:4,则配平方程式为:16Al+9NO3-+7OH-=16AlO2-+4N2↑+NH3↑+2H2O;已知0.2molNO3-,
16Al+9NO3-+7OH-=16AlO2-+4N2↑+NH3↑+2H2O
16 9
n(Al) 0.2mol
n(Al)=$\frac{3.2}{9}$mol,
则Al的质量为:$\frac{3.2}{9}$mol×27 g•mol-1=9.6g
故答案为:9.6.
点评 本题考查无机物的推断及离子反应,为高频考点,把握实验流程中的反应、现象及离子推断为解答的关键,侧重分析与推断能力的考查,注意离子反应及元素化合物知识的综合应用,题目难度不大.

 阅读快车系列答案
阅读快车系列答案| A. | 次氯酸钠 | B. | 氯化钠 | C. | 氢氧化钡 | D. | 氯化铁 |
| A. | 向Mg(HCO3)2溶液中加入过量的NaOH溶液:Mg2++2HCO3-+4OH-═Mg(OH)2↓+2CO32-+2H2O | |
| B. | 金属铁与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 钠与水反应:2Na+2H2O═2Na++2OH-+H2↑ | |
| D. | FeCl2溶液和Cl2反应:2Fe2++Cl2═2Fe3++2Cl- |
| A. | 标准状况下,2.24 L 16O 2和3.6 g 18O 2均含有0.2N A个氧原子 | |
| B. | 1.7 g H 218O 2中含有的电子数为0.9 N A | |
| C. | 电解精炼铜时,若阴极得到N A个电子,则阳极质量减少32g | |
| D. | 标准状况下,2.24 L甲烷、戊烷混合物所含分子数为0.1N A |
| A. | 沸点:H2O>H2Se>H2S | B. | 熔点:Na>Mg>Al | ||
| C. | 晶格能:NaF>NaCl>NaBr | D. | 硬度:MgO>CaO>BaO |
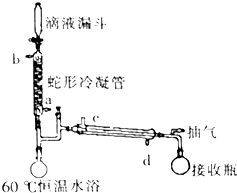 过氧乙酸是高效、速效、广谱灭菌剂.实验室合成与含量测定的相关步骤如下:
过氧乙酸是高效、速效、广谱灭菌剂.实验室合成与含量测定的相关步骤如下: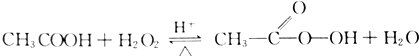 ,向装有搅拌装置及温度计的500ml三口烧瓶中先加入16.0g冰醋酸,然后在搅拌下滴加90g浓缩后的H2O2溶液,最后加入7.5ml浓硫酸,搅拌下加热5h,静置20h.
,向装有搅拌装置及温度计的500ml三口烧瓶中先加入16.0g冰醋酸,然后在搅拌下滴加90g浓缩后的H2O2溶液,最后加入7.5ml浓硫酸,搅拌下加热5h,静置20h.
 在一定温度下,冰醋酸加水稀释过程中溶液的导电能力如图所示,请回答:
在一定温度下,冰醋酸加水稀释过程中溶液的导电能力如图所示,请回答: