题目内容
6.工业制硝酸经以下一系列反应:
请回答:
(1)写出N2的一种用途工业合成氨.
(2)写出反应④的化学方程式3NO2+H2O=2HNO3+NO,实验室收集NO的方法是排水法.
(3)对于氮的化合物,下列说法不正确的是(选填序号字母)d.
a.氨可用作制冷剂
b.铵态氮肥一般不能与碱性化肥共同使用
c.硝酸可用于制化肥、农药、炸药、染料、盐类等
d.某浓硝酸中含有溶质2mol,标准状况下,该浓硝酸与足量的铜完全反应能生成1mol NO2
(4)已知:H2(g)+1/2O2(g)=H2O(g)△H1=-241.8kJ/mol
N2(g)+3H2(g)=2NH3(g)△H2=-92.0kJ/mol
写出氨气与氧气反应生成N2(g)与H2O(g)时的热化学方程式2NH3+$\frac{3}{2}$O2(g)=N2(g)+3H2O(g)△H=-633.4KJ/mol.
分析 工业制硝酸经以下一系列反应:
(1)N2的一种用途是工业上合成氨;
(2)反应④是二氧化氮和水反应生成硝酸和一氧化氮;一氧化氮不溶于水,易被空气中的氧气氧化选择收集方法;
(3)a.氨液化后挥发带走能量,所以可用作制冷剂;
b.铵态氮肥溶解后铵根离子水解显酸性;
c.依据硝酸的性质和应用分析;
d.某浓硝酸中含有溶质2mol,标准状况下,该浓硝酸与足量的铜完全反,随反应进行硝酸变稀后生成一氧化氮;
(4)依据热化学方程式和盖斯定律计算得到所需热化学方程式.
解答 解:(1)氮气的用途是工业合成氨,保护气等,故答案为:工业合成氨;
(2)反应④是二氧化氮和水反应生成硝酸和一氧化氮,反应的化学方程式3NO2+H2O=2HNO3+NO;一氧化氮不溶于水,易被空气中的氧气氧化选择收集方法,实验室收集NO的方法是排水法;
故答案为:3NO2+H2O=2HNO3+NO;排水法;
(3)a.液氨挥发过程中吸收能量,可用作制冷剂,故a正确;
b.铵态氮肥溶解后铵根离子水解显酸性,一般不能与碱性化肥共同使用,故b正确;
c.硝酸可用于制化肥、农药、炸药、染料、盐类等,故c正确;
d.某浓硝酸中含有溶质2mol,标准状况下,该浓硝酸与足量的铜完全反应,随反应进行溶液浓度变稀后反应生成一氧化氮气体,生成NO2 小于1mol,故d错误;
故答案为:d;
(4)①H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H1=-241.8kJ/mol
②N2(g)+3H2(g)=2NH3(g)△H2=-92.0kJ/mol
依据盖斯定律①×3-②得到:2NH3+$\frac{3}{2}$O2(g)=N2(g)+3H2O(g)△H=-633.4KJ/mol,
故答案为:2NH3+$\frac{3}{2}$O2(g)=N2(g)+3H2O(g)△H=-633.4KJ/mol.
点评 本题考查了氮及其化合物性质的分析应用,热化学方程式书写方法,是一道元素及化合物性质的综合题,难度中等,要求学生具备分析和解决问题的能力.

2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=-1 452kJ•mol-1
H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1下列说法正确的是( )
| A. | H2(g)的燃烧热为285.8 kJ•mol-1 | |
| B. | $\frac{1}{2}$H2SO4(aq)+$\frac{1}{2}$Ba(OH)2(aq)═$\frac{1}{2}$BaSO4(s)+H2O(l)△H=-57.3 kJ•mol-1 | |
| C. | 同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多 | |
| D. | 3H2(g)+CO2(g)═CH3OH(l)+H2O(l)△H=+131.4 kJ•mol-1 |
| A. | ①和②混合溶液中:c(H+)=3.0mol•L-1 | |
| B. | ①和④混合溶液中:c(Na+)=c(CH3COO-)+c(CH3COOH) | |
| C. | ②和③混合溶液中:c(Cl-)>c(NH4+) | |
| D. | 四种溶液稀释100倍,溶液的pH:③>④>②>① |
| A. | 生成42.0 L N2(标准状况) | |
| B. | 有0.250 mol KNO3被氧化 | |
| C. | 转移电子的物质的量为1.25 mol | |
| D. | 被氧化的氮原子的物质的量为1.75 mol |
| A. | CH3CH2Br | B. | CH3CH2OH | C. | 苯酚 | D. | CH2═CHBr |
| 元素代号 | X | Y | Z | R | W |
| 原子半径/pm | 160 | 143 | 89 | 70 | 66 |
| 主要化合价 | +2 | +3 | +2 | +5、-3 | -2 |
| A. | X、Z元素的金属性:X<Z | |
| B. | 一定条件下,R单质与常见的W单质能直接生成RW2 | |
| C. | 气态氢化物的稳定性:R>W | |
| D. | Y的最高价氧化物既能溶于H2SO4又能溶于NaOH |
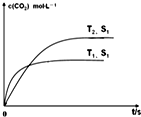 汽车尾气净化的主要原理为:2NO(g)+2CO(g)?2CO2(g)+N2(g)△H<0
汽车尾气净化的主要原理为:2NO(g)+2CO(g)?2CO2(g)+N2(g)△H<0 C和Si元素在化学中占有极其重要的地位.
C和Si元素在化学中占有极其重要的地位. ;MO是优良的耐高温材料,其晶体结构与NaCl晶体相似,则每个M2+周围吸引6个O2-;每个MO晶胞中含有4个M2+和4个O2-; MO的熔点比CaO的高,其原因是Mg 2+半径比Ca 2+小,MgO的晶格能大.
;MO是优良的耐高温材料,其晶体结构与NaCl晶体相似,则每个M2+周围吸引6个O2-;每个MO晶胞中含有4个M2+和4个O2-; MO的熔点比CaO的高,其原因是Mg 2+半径比Ca 2+小,MgO的晶格能大.