题目内容
有关如图装置中的叙述正确的是( )


| A、这是电解NaOH溶液的装置 |
| B、这是一个原电池装置 |
| C、Pt为负极,其电极反应为:O2+2H2O+4e-═4OH- |
| D、Fe为阳极,其电极反应为:Fe-2e-+2OH-═2Fe(OH)2 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:该装置中,电解质溶液呈中性,铁发生吸氧腐蚀,铁易失电子而作负极,亚铁离子和氢氧根离子反应生成氢氧化亚铁程度,电极反应式为Fe-2e-+2OH-═2Fe(OH)2,铂作正极,正极上氧气得电子发生还原反应,电极反应式为O2+2H2O+4e-═4OH-,据此分析解答.
解答:
解:A.该装置没有外接电源,属于原电池而不是电解池,故A错误;
B.该装置能自发的进行氧化还原反应,符合原电池构成条件,所以为原电池,故B正确;
C.铁易失电子作负极,铂作正极,正极上氧气得电子发生还原反应,电极反应式为O2+2H2O+4e-═4OH-,故C错误;
D.铁作负极,电极反应式为Fe-2e-+2OH-═2Fe(OH)2,故D错误;
故选B.
B.该装置能自发的进行氧化还原反应,符合原电池构成条件,所以为原电池,故B正确;
C.铁易失电子作负极,铂作正极,正极上氧气得电子发生还原反应,电极反应式为O2+2H2O+4e-═4OH-,故C错误;
D.铁作负极,电极反应式为Fe-2e-+2OH-═2Fe(OH)2,故D错误;
故选B.
点评:本题以铁的吸氧腐蚀为载体考查了原电池原理,根据原电池构成条件确定装置名称,再结合正负极上电极反应式来分析解答,难点是电极反应式的书写,注意亚铁离子和氢氧根离子不能共存,为易错点.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
下列说法不正确的是( )
| A、金属单质和盐溶液的反应都属于置换反应 |
| B、质量数相等的不同核素,一定属于不同种元素 |
| C、室温下,等浓度的酸HA比盐酸的导电能力弱,所以HA属于弱电解质 |
| D、A12O3既能与强酸反应,又能与强碱反应,所以A12O3属于两性氧化物 |
下列方程式属于水解反应方程式的是( )
| A、H2CO3?HCO3-+H+ |
| B、HCO3-+H2O?H3O++CO32- |
| C、HCO3-+OH-═H2O+CO32- |
| D、CO32-+H2O?HCO3-+OH- |
将SO2气体与足量Fe2(SO4)3溶液完全反应后,再加入K2Cr2O7溶液,发生如下两个化学反应:
①SO2+2Fe3++2H2O=SO42-+2Fe2++4H+
②Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,下列有关说法错误的是( )
①SO2+2Fe3++2H2O=SO42-+2Fe2++4H+
②Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,下列有关说法错误的是( )
| A、氧化性Cr2O72->Fe3+>SO2 |
| B、K2Cr2O7能将Na2SO3氧化成Na2SO4 |
| C、每有1molK2Cr2O7参加反应,转移电子的数目为6NA |
| D、若6.72 L SO2(标准状况)参加反应,则最终消耗0.2molK2Cr2O7 |
下列各表述与示意图一致的是( )
A、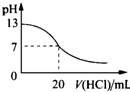 此图表示25℃时,用0.1mol/L盐酸滴定20mL 0.1mol/L NaOH溶液,溶液的pH随加入酸体积的变化得到的滴定曲线 |
B、 此图表示一定条件下进行的反应2SO2(g)+O2(g)═2SO3(g)△H<0各成分的物质的量变化,t2时刻改变的条件可能是降低温度或缩小容器体积 |
C、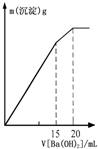 此图表示某明矾溶液中加入Ba(OH)2溶液,沉淀的质量与加入Ba(OH)2溶液体积的关系,在加入20mL Ba(OH)2溶液时铝离子恰好沉淀完全 |
D、 此图表示化学反应H2(g)+C12(g)═2HCl(g)的能量变化,则该反应的反应热△H=﹢183kJ/mol |
已知某溶液中存在较多的H+、SO42-、NO3-,则溶液中还可能大量存在的离子组是( )
| A、Na2+、Ba2+、Br- |
| B、Na+、NH4+、SO32- |
| C、Mg2+、C1-、Fe2+ |
| D、A13+、Na+、C1- |
设阿伏加德罗常数为NA,下列叙述中正确的是( )
| A、常温常压下,32克氧气中原子个数为2NA |
| B、标准状况下,1mol H2O的体积为22.4L |
| C、常温常压下,1molH2的质量为2克 |
| D、物质的量浓度为0.5mol/L的MgCl2溶液中,含有的Cl-数为NA |