题目内容
关于化学反应速率的说法正确的是( )
| A、化学反应速率可表示可逆反应进行的程度 |
| B、根据化学反应速率的大小可知化学反应进行的快慢 |
| C、化学反应速率是指一定时间内,任何一种反应物浓度的减少或任何一种生成物浓度的增加 |
| D、对于任何化学反应来说,反应速率越大,反应现象越明显 |
考点:化学反应速率的影响因素
专题:化学反应速率专题
分析:A、化学反应速率可表示可逆反应进行的快慢;
B、化学反应速率的大小是衡量反应快慢的物理量;
C、固体和纯液体不能表示反应速率;
D、有些反应无反应现象.
B、化学反应速率的大小是衡量反应快慢的物理量;
C、固体和纯液体不能表示反应速率;
D、有些反应无反应现象.
解答:
解:A、化学反应速率可表示可逆反应进行的快慢,平衡常数表示反应进行的程度,故A错误;
B、化学反应速率的大小是衡量反应快慢的物理量,根据化学反应速率的大小可知化学反应进行的快慢,故B正确;
C、反应中固体和纯液体不能表示反应速率,故C错误;
D、有些反应无反应现象,如酸碱中和反应,盐酸和氢氧化钠溶液反应瞬间进行速率大,但反应现象不明显,故D错误;
故选B.
B、化学反应速率的大小是衡量反应快慢的物理量,根据化学反应速率的大小可知化学反应进行的快慢,故B正确;
C、反应中固体和纯液体不能表示反应速率,故C错误;
D、有些反应无反应现象,如酸碱中和反应,盐酸和氢氧化钠溶液反应瞬间进行速率大,但反应现象不明显,故D错误;
故选B.
点评:本题考查了化学反应速率概念的分析判断,注意速率计算的方法应用,反应现象和反应快慢无直接关系,题目较简单.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列离子方程式正确的是( )
| A、钠与水反应:Na+2H2O=Na++2OH-+H2↑ |
| B、碳酸钠溶液中加入澄清石灰水 Ca(OH) 2+CO32-=CaCO3↓+2OH- |
| C、氢氧化钡溶液与稀H2SO4 反应:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
| D、将氯气溶于水制备次氯酸:Cl2+H2O=H++Cl-+HClO |
生物学家借助新的显微技术,成功观察到小于200纳米的粒子.下列分散系中,分散质粒子半径最小的是
( )
( )
| A、雾 | B、墨水 |
| C、石灰乳 | D、KCl溶液 |
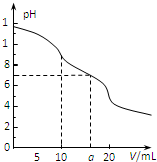 常温下,用 0.1mol?L-1 HCl溶液滴定10.0mL浓度为0.1mol?L-1 Na2CO3溶液,所得滴定曲线如图所示.下列说法不正确的是( )
常温下,用 0.1mol?L-1 HCl溶液滴定10.0mL浓度为0.1mol?L-1 Na2CO3溶液,所得滴定曲线如图所示.下列说法不正确的是( )| A、当V=0时:c(H+)+c(HCO3-)+2c(H2CO3)=c(OH-) |
| B、当V=5时:c(CO32-)+c(HCO3-)+c(H2CO3)=2c(Cl-) |
| C、当V=10时:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
| D、当V=a时:c(Na+)>c(Cl-)>c(H+)=c(OH-) |
四种基本反应类型和氧化还原反应的关系表示不正确的是( )
| A、置换反应一定是氧化还原反应 |
| B、复分解反应一定不是氧化还原反应 |
| C、化合反应一定是氧化还原反应 |
| D、分解反应不一定是氧化还原反应 |
在容积固定不变的密闭容器中加入1mol N2和3mol H2发生反应:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ?mol-1,下列结论正确的是( )
| A、该反应达到平衡时,放出的热量等于92.4kJ |
| B、达到平衡后向容器中通入1mol氦气,平衡正向移动 |
| C、若达到平衡时N2的转化率为20%,则平衡时容器内的压强是起始时的80% |
| D、若达到平衡时N2的转化率为20%,则平衡时容器内的压强是起始时的90% |
溶液中含有两种溶质氯化钠和硫酸,它们的物质的量之比为3:1.用石墨做电极电解该溶液时,根据反应产物可明显分为三个阶段,则下列叙述不正确的是( )
| A、电解过程中阴极析出的气体和阳极析出的气体可能一样多 |
| B、阳极先析出氯气后析出氧气 |
| C、电解最后阶段为电解水 |
| D、电解过程中溶液的pH不断增大,最后pH为7 |
汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3=K2O+5Na2O+16N2↑.若氧化产物比还原产物多1.75mol,则下列判断不正确的是( )
| A、生成44.8 L N2(标准状况) |
| B、有0.250 mol KNO3被氧化 |
| C、转移电子的物质的量为1.25 mol |
| D、被氧化的N原子的物质的量为3.75 mol |
下列与碳、氮、氧、硫、硅等非金属元素及其化合物有关的说法不正确的是( )
| A、氮的氧化物是形成光化学烟雾的主要物质,硫的氧化物是形成酸雨的主要物质 |
| B、工业上,用焦炭在电炉中还原二氧化硅得到含杂质的粗硅 |
| C、将SO2通入酸化的Ba(NO3)2溶液中会出现白色沉淀 |
| D、NO2、CO2和SO2溶于水均可导电,它们都是电解质 |