题目内容
15.常温时,有以下试剂:①蒸馏水②0.01mol/L的盐酸③pH=12的氨水④pH=ll的碳酸钠溶液,上述溶液中由水电离的c(H+)关系正确的是( )| A. | ②>① | B. | ③>④ | C. | ①>④ | D. | ②=③ |
分析 电离平衡为H2O?H++OH-,在水中加入酸或者碱溶液,导致溶液中氢离子或者氢氧根离子浓度增大,抑制了水的电离;酸溶液中氢氧根离子是水电离的,碱溶液中氢离子是水电离,据此计算出各项水电离的氢离子浓度.
解答 解:酸溶液中,氢氧根离子是水电离,碱溶液中氢离子是水电离的.
①蒸馏水中,氢离子和氢氧根均全部来自于水的电离,故由水电离的c(H+)=10-7mol/L;
②0.01mol/L盐酸,溶液中氢离子浓度为0.01mol/L,主要来自于水的电离,氢氧根全部来自于水的电离,故水电离的氢氧根离子为:$\frac{1{0}^{-14}}{0.01}$mol/L=1×10-12mol/L;
③pH=12的氨水中,氢离子全部来自于水的电离,氢氧根几乎全部来自于水的电离,故溶液中水电离出的氢离子浓度为1×10-12mol/L;
④pH=11的碳酸钠溶液中,c(H+)=10-11mol/L,c(OH-)=10-3mol/L,由于碳酸根能结合水电离出的氢离子,故氢氧根的浓度能代表水电离出的全部氢氧根,故溶液中由水电离出的氢原子的浓度为1×10-3mol/L.
所以由水电离产生的c(H+)④>①>②=③,故选D.
点评 本题考查了水的电离,题目难度中等,解题关键是合理判断酸碱溶液中水电离情况分析及计算方法,注意酸溶液中,氢氧根离子是水电离,碱溶液中氢离子是水电离的.

练习册系列答案
相关题目
3.五种短周期元素在元素周期表中的相对位置如表所示,其中E的非金属性在同周期元素中最强,下列说法正确的是( )
| A | B | |||
| C | D | E |
| A. | 简单离子的半径:D>E>C>B | |
| B. | 氧化物对应的水化物的酸性:E-定强于D | |
| C. | B、D分别与氢元素形成的化合物的沸点:D>B | |
| D. | A的最高价氧化物的水化物能与A的氢化物反应生成离子化合物 |
10.对下列各图描述不正确的是( )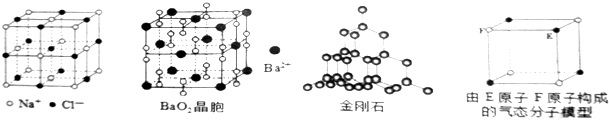

| A. | 在NaCI晶体中,距Na+最近的Cl-有6个 | |
| B. | 在BaO2晶胞中,每个晶胞平均占有4个Ba2+和4个022- | |
| C. | 在金刚石晶体中,碳原子与碳碳键的个数比为1:2 | |
| D. | 该气态分子的分子式为EF或FE |
20.中华民族有着光辉灿烂的发明史,下列发明创造不涉及氧化还原反应的是( )
| A. | 用胆矾炼铜 | B. | 用铁矿石炼铁 | ||
| C. | 黑火药的使用 | D. | 打磨磁石制指南针 |
7.下列有关说法正确的是( )
| A. | 光化学烟雾是氮氧化物与碳氢化合物受紫外线作用后产生的有毒烟雾 | |
| B. | pH小于7的雨水都是酸雨 | |
| C. | PM2.5含量的增加是形成雾霾天气的重要原因之一 | |
| D. | 大气中CO2含量的增加会导致温室效应加剧 |
5.下列有机物中含有两种官能团的是( )
| A. | CH2=CHCl | B. |  | C. |  | D. |  |
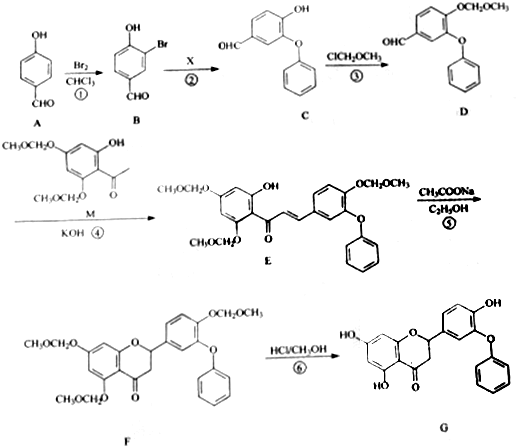
 .
.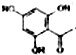 制得,写出同时满足下列条件的
制得,写出同时满足下列条件的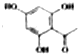 的一种同分异构体的结构简式
的一种同分异构体的结构简式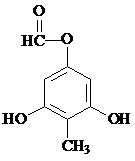 或
或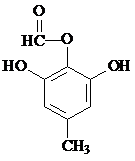 .
. 为原料,合成
为原料,合成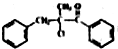 ,写出合成流程图
,写出合成流程图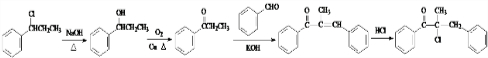 (无机试剂作用).合成流程图示例如下:CH2-CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.
(无机试剂作用).合成流程图示例如下:CH2-CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.