题目内容
10.对下列各图描述不正确的是( )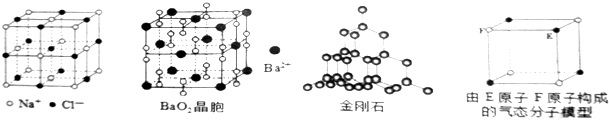
| A. | 在NaCI晶体中,距Na+最近的Cl-有6个 | |
| B. | 在BaO2晶胞中,每个晶胞平均占有4个Ba2+和4个022- | |
| C. | 在金刚石晶体中,碳原子与碳碳键的个数比为1:2 | |
| D. | 该气态分子的分子式为EF或FE |
分析 A、根据在NaCl晶体中,距Na+最近的Cl-有6个进行分析;
B、Ba2+位于晶胞的顶点和面心,022-位于晶胞的棱和体心,利用均摊法计算;
C、根据用均摊法分析;
D、注意气态团簇分子与晶胞的区别.
解答 解:A、在NaCl晶体中,距Na+最近的Cl-有6个,所以钠离子的配位数是6,故A正确;
B、Ba2+位于晶胞的顶点和面心,晶胞中含有Ba2+的个数为:8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,022-位于晶胞的棱和体心,晶胞中含有022-的个数为:12×$\frac{1}{3}+1$=4,故B正确;
C、在金刚石晶体中,每个碳原子形成4个共价键,每两个碳原子形成一个共价键,则每个碳原子形成的共价键平均为4×$\frac{1}{2}$=2,所以在金刚石晶体中,碳原子与碳碳键数之比为1:2,故C正确;
D、气态团簇分子不同于晶胞,气态团簇分子中含有4个E原子,4个F原子,则分子式为E4F4或F4E4,故D错误.
故选D.
点评 本题考查晶胞的计算,题目难度较大,本题尤其注意气态团簇分子与晶胞的区别,为本题的易错点.

练习册系列答案
相关题目
20.下列解释事实的方程式不正确的是( )
| A. | 氨水显碱性:NH3•H2O═NH4++OH- | |
| B. | 将Na块放入水中,产生气体:2Na+2H2O═2NaOH+H2↑ | |
| C. | 用CuCl2溶液做导电实验,灯泡发光:CuCl2$\frac{\underline{\;通电\;}}{\;}$Cu2++2Cl- | |
| D. | Al片溶于NaOH溶液中,产生气体:2Al+2OH-+2H2O═2AlO2-+3H2↑ |
1.下列变化需加入还原剂的是( )
| A. | HCO3-→CO2 | B. | MnO4-→Mn2+ | C. | Fe2+→Fe3+ | D. | H+→H2O |
5.三聚氰酸的结构如图所示,下列有关三聚氰酸的说法不正确的是( )
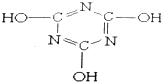

| A. | 分子式为C3H3N303 | B. | 属于共价化合物 | ||
| C. | 分子中只含极性键,不含非极性键 | D. | 该分子中的C原子采取sp3杂化 |
15.常温时,有以下试剂:①蒸馏水②0.01mol/L的盐酸③pH=12的氨水④pH=ll的碳酸钠溶液,上述溶液中由水电离的c(H+)关系正确的是( )
| A. | ②>① | B. | ③>④ | C. | ①>④ | D. | ②=③ |
2.用如图表示的一些物质或概念间的从属关系中,正确的是( )
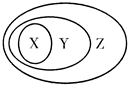

| A. | X是氧化物Y是化合物Z是纯净物 | |
| B. | X是非金属单质Y是非电解质Z是纯净物 | |
| C. | X是金属氧化物Y是碱性氧化物Z氧化物是 | |
| D. | X是置换反应Y是氧化还原反应Z是离子反应 |
19.利用如图电解装置从海水中提取CO2,可减少温室气体含量,下列说法错误的是( )
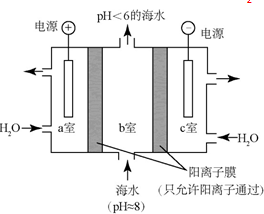

| A. | a室的电极接电源的负极 | |
| B. | 该装置将电能转化为化学能 | |
| C. | c室排出的碱液中含有NaOH | |
| D. | a室的电极反应式为:4OH--4e-═2H2O+O2↑ |
20.下列每组中各有三对物质,它们都能用分液漏斗分离的是( )
| A. | 乙酸乙酯和水,酒精和水,植物油和水 | |
| B. | 四氯化碳和水,溴苯和水,硝基苯和水 | |
| C. | 甘油和水,乙酸和水,乙酸和乙醇 | |
| D. | 汽油和水,溴苯和水,苯酚和酒精 |