题目内容
(1)下列物质:①能导电的是 ; ②属于电解质的是 ;③属于非电解质的是 ;
A.NaOH溶液;B.Cu;C.液态HCl;D.液态CH3COOH;E.蔗糖溶液;F.液氨G.氨水;H.CuSO4溶液;I.石墨;J.无水乙醇
(2)在2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O反应中,氧化剂是 ,氧化产物是 ,
(3)被氧化与未被氧化的HCl的质量之比为 ,若有7.3gHCl被氧化,产生Cl2的质量为 g.
(4)用双线桥标出电子转移方向和总数.
A.NaOH溶液;B.Cu;C.液态HCl;D.液态CH3COOH;E.蔗糖溶液;F.液氨G.氨水;H.CuSO4溶液;I.石墨;J.无水乙醇
(2)在2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O反应中,氧化剂是
(3)被氧化与未被氧化的HCl的质量之比为
(4)用双线桥标出电子转移方向和总数.
考点:氧化还原反应的计算,电解质与非电解质
专题:
分析:金属以及在熔融状态或水溶液中存在自由移动的离子时,可导电;结合电解质、非电解质的定义判断;
在2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O反应中,Mn元素化合价降低,被氧化,KMnO4为氧化剂,Cl元素化合价升高,被氧化,HCl为还原剂,以此解答.
在2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O反应中,Mn元素化合价降低,被氧化,KMnO4为氧化剂,Cl元素化合价升高,被氧化,HCl为还原剂,以此解答.
解答:
解:(1)含有自由移动的电子或离子的物质能够导电,满足条件的有A、B、G、H、I;
电解质为在水溶液或者熔融状态下能够导电的化合物,满足条件的为CD;
非电解质为在水溶液和熔融状态下都不导电的化合物,满足条件为FJ,
故答案为:ABGHI;CD;FJ;
(2)在2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O反应中,Mn元素化合价降低,被氧化,KMnO4为氧化剂,Cl元素化合价升高,被氧化,HCl为还原剂,Cl2为氧化产物,故答案为:2KMnO4;Cl2;
(3)由方程式可知,当有16molHCl参加反应时,有10molHCl被氧化,则被氧化与未被氧化的HCl的质量之比为10:6=5:3,若有7.3g即0.2molHCl被氧化,则生成0.1molCl2,质量为7.1g,
故答案为:5:3;7.1;
(4)反应中KMnO4为氧化剂,Mn元素的化合价由+7价降低到+2价,得到5个电子,Cl元素化合价升高,被氧化,当有2molKMnO4参加反应,转移电子10mol,则电子转移的方向和数目可表示为 ,
,
故答案为: .
.
电解质为在水溶液或者熔融状态下能够导电的化合物,满足条件的为CD;
非电解质为在水溶液和熔融状态下都不导电的化合物,满足条件为FJ,
故答案为:ABGHI;CD;FJ;
(2)在2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O反应中,Mn元素化合价降低,被氧化,KMnO4为氧化剂,Cl元素化合价升高,被氧化,HCl为还原剂,Cl2为氧化产物,故答案为:2KMnO4;Cl2;
(3)由方程式可知,当有16molHCl参加反应时,有10molHCl被氧化,则被氧化与未被氧化的HCl的质量之比为10:6=5:3,若有7.3g即0.2molHCl被氧化,则生成0.1molCl2,质量为7.1g,
故答案为:5:3;7.1;
(4)反应中KMnO4为氧化剂,Mn元素的化合价由+7价降低到+2价,得到5个电子,Cl元素化合价升高,被氧化,当有2molKMnO4参加反应,转移电子10mol,则电子转移的方向和数目可表示为
 ,
,故答案为:
 .
.
点评:本题考查氧化还原反应,侧重于电子转移的方向和数目的判断以及氧化还原反应的相关计算,注意根据反应的化学方程式结合元素化合价的变化解答该类题目.

练习册系列答案
相关题目
下列有关实验原理或操作正确的是( )
| A、实验室将Na2SO3溶液直接加热蒸发结晶可得到Na2SO3晶体 |
| B、用湿润的pH试纸来检验溶液的pH值 |
| C、用KSCN溶液检验硫酸亚铁溶液是否氧化变质 |
| D、用四氯化碳萃取溴的苯溶液中的溴 |
通过一个阶段的复习,你认为下列说法正确的是( )
| A、酸和碱一定能发生中和反应 |
| B、同种元素的化合价越高氧化性一定越强 |
| C、某化合物如果不是电解质就一定是非电解质 |
| D、对于可逆反,温度升高则该反应的平衡常数一定增大 |
化学与生产、生活息息相关,下列说法不正确的是( )
| A、自行车钢架生锈主要是电化学腐蚀所致 |
| B、玻璃容器内壁中沉积的CaSO4可用Na2CO3溶液浸泡后再加酸除去 |
| C、在工业合成氨中温度越高反应速度越快,越有利于提高N2的转化率 |
| D、生活中使用明矾净水,是利用了Al3+水解生成的Al(OH)3胶体吸附杂质的原理 |
根据如图,下列判断正确的是( )
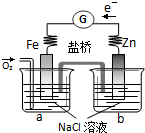

| A、电子从Zn极流出,流入Fe极,经盐桥回到Zn极 |
| B、烧杯a中发生反应O2+4H++4e-=2H2O,溶液pH升高 |
| C、烧杯b中发生的电极反应为Zn-2e-=Zn2+ |
| D、向烧杯a中加入少量K3Fe(CN)6溶液,有蓝色沉淀生成 |
毒品曾给我们的国家和民族带来过巨大的灾难,据统计我国目前的吸毒人员中80%左右是青少年,而他们大多又是出于好奇而沾染毒品的.根据你的知识判断下列物质中一定不属于毒品的是( )
| A、甘油 | B、吗啡 | C、冰毒 | D、海洛因 |
已知反应:①2C(s)+O2(g)=2CO(g)△H=-221kJ/mol
②稀溶液中,H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol下列结论正确的是( )
②稀溶液中,H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol下列结论正确的是( )
| A、碳的燃烧热大于110.5 kJ/mol |
| B、①的反应热为221 kJ/mol |
| C、稀硫酸与稀NaOH溶液反应的中和热为57.3 kJ/mol |
| D、稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ 热量 |
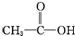 ②CH3CH2-OH ③H-OH ④
②CH3CH2-OH ③H-OH ④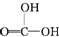 四种物质中羟基上氢原子的活泼性顺序.
四种物质中羟基上氢原子的活泼性顺序.