题目内容
高铁酸钾(K2FeO4)是一种兼具净水和消毒功能的可溶性盐,可发生如下反应:2K2FeO4+16HCl═4KCl+2FeCl3+8H2O+3Q↑,下列说法正确的是( )
| A、可用湿润的淀粉碘化钾试纸检验产物Q |
| B、K2FeO4在水中的电离方程式为K2FeO4═2K++Fe6++4O2一 |
| C、反应中氧化剂与还原剂的物质的量之比为1:8 |
| D、反应中涉及的6种物质均为电解质 |
考点:氧化还原反应
专题:氧化还原反应专题
分析:已知2K2FeO4+16HCl═4KCl+2FeCl3+8H2O+3Q↑,根据元素守恒可知Q为氯气,Fe元素的化合价由+6价降低为+3价,Cl元素的化合价-1价升高为0价,以此来解答.
解答:
解:A.Q为氯气,可用湿润的淀粉碘化钾试纸检验产物氯气,故A正确;
B.K2FeO4在水中的电离方程式为K2FeO4═2K++FeO42-,故B错误;
C.反应中16molHCl参加反应只有6mol被氧化,则反应中氧化剂与还原剂的物质的量之比为1:3,故C错误;
D.产物Q为氯气,氯气为单质不是电解质,故D错误;
故选A.
B.K2FeO4在水中的电离方程式为K2FeO4═2K++FeO42-,故B错误;
C.反应中16molHCl参加反应只有6mol被氧化,则反应中氧化剂与还原剂的物质的量之比为1:3,故C错误;
D.产物Q为氯气,氯气为单质不是电解质,故D错误;
故选A.
点评:本题考查氧化还原反应,把握反应中元素的化合价变化为解答的关键,考查点较多,题目难度不大.

练习册系列答案
相关题目
下列鉴别实验中,所选试剂不合理的是( )
| A、用高锰酸钾酸性溶液鉴别甲苯和己烯 |
| B、用水鉴别苯和四氯化碳 |
| C、用饱和碳酸钠溶液鉴别乙酸和乙酸乙酯 |
| D、用新制的氢氧化铜鉴别乙醛和乙醇 |
下列溶液中,微粒的物质的量浓度关系正确的是( )
| A、某盐Na2 CO3溶液中:c(OH-)+2c(CO32-)+c(H CO3-)=c(H+)+c(Na+) |
| B、常温时,将PH=1的醋酸和PH=13的Na OH溶液等体积混合后的溶液c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| C、NaHCO3溶液中:c(Na+)=2c(CO32-)+c(HCO3-)+c(H2CO3) |
| D、0.1 mol?L-1(NH4)2Fe(SO4)2溶液中:c(NH4+)+c(NH3?H2O)=0.2 mol |
A和B反应生成C和D的微观示意图如图所示,根据图中信息判断,下列说法错误的是( )
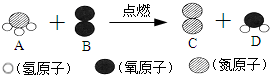

| A、反应前后,分子的种类发生了改变 | ||||
| B、A由一个氮元素和三个氢元素组成 | ||||
| C、D中氢元素和氧元素的质量比为1:8 | ||||
D、配平后的化学方程式为:4NH3+3O2
|
下列化学用语表达正确的是( )
A、对硝基甲苯的结构简式: |
B、CH2F2的电子式: |
C、苯分子的比例模型: |
| D、16O2与18O2互为同素异形体 |
标准状况下,1mol H2O和1molH2相同的是( )
| A、质量 | B、体积 |
| C、原子数 | D、分子数 |
设NA代表阿伏加德罗常数的值.下列说法错误的是( )
| A、30g甲醛(CH2O)与30g葡萄糖均含有NA个碳原子 |
| B、0.1molCl2与过量稀NaOH 溶液作用转移电子数0.2NA |
| C、常温下,1L pH=1的硫酸由水电离出的H+ 约为1×10-13NA |
| D、石墨电极电解CuSO4 溶液,阴极上有4mol电子转移,阳极上有NA个O2 |
下列计算结果正确是( )
| A、向含有1mol AlCl3的溶液中加入足量NaOH溶液就会产生1molAl(OH)3的白色沉淀 | ||
| B、将64g 铜片投入到100ml 18 mol/L的浓硫酸中会产生22.4L的SO2气体 | ||
| C、向1mol的碳酸钾固体中缓缓滴加0.2mol的稀盐酸会产生2.24L的CO2气体 | ||
D、标准状况下,用一充满HCl气体的干燥烧瓶做喷泉实验,当水充满整个烧瓶后(假设溶液不外溢),烧瓶内盐酸的物质的量的浓度为
|