题目内容
按C、N、O、F的顺序,下列递变规律错误的是( )
| A、原子半径逐渐减小 |
| B、元素原子得电子能力逐渐增强 |
| C、最高正化合价逐渐增大 |
| D、气态氢化物稳定性逐渐增大 |
考点:元素周期律的作用
专题:元素周期律与元素周期表专题
分析:C、N、O、F在周期表相同周期,从左到右原子序数逐渐增大,根据周期律的递变规律解答该题.
解答:
解:C、N、O、F在周期表相同周期,从左到右原子序数逐渐增大,
A.同周期,从左到右原子半径逐渐减小,所以C、N、O、F的原子半径逐渐减小,故A正确;
B.同周期元素从左到右元素的非金属性逐渐增强,则C、N、O、F得电子能力逐渐增强,故B正确;
C.O、F没有最高正价,C、N的最高正化合价逐渐增大,故C错误;
D.同周期元素从左到右元素的非金属性逐渐增强,对应的气态氢化物稳定性逐渐增强,则C、N、O、F的氢化物的稳定性逐渐增强,故D正确.
故选C.
A.同周期,从左到右原子半径逐渐减小,所以C、N、O、F的原子半径逐渐减小,故A正确;
B.同周期元素从左到右元素的非金属性逐渐增强,则C、N、O、F得电子能力逐渐增强,故B正确;
C.O、F没有最高正价,C、N的最高正化合价逐渐增大,故C错误;
D.同周期元素从左到右元素的非金属性逐渐增强,对应的气态氢化物稳定性逐渐增强,则C、N、O、F的氢化物的稳定性逐渐增强,故D正确.
故选C.
点评:本题考查同周期元素的性质的递变规律,题目难度不大,注意元素周期表与元素周期律的相互关系.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列有关物质性质的说法正确的是( )
| A、乙醇可以发生的反应类型有:取代反应、消去反应、加成反应 |
| B、乙酸和苯酚的水溶液都有酸性,都能和小苏打反应放出气体 |
| C、将Cl2和SO2的混合气体通入到品红溶液中,颜色肯定不褪去 |
| D、向氢氧化铁胶体中滴加稀硫酸,开始有沉淀生成,而后会溶解 |
下列不属于洗涤剂的是( )
| A、肥皂 | B、洗衣粉 |
| C、洗洁精 | D、漂白粉 |
下列用途主要是体现铝的物理性质的是( )
①家用铝锅 ②盛浓硝酸的容器 ③制导线 ④焊接钢轨 ⑤包装铝箔 ⑥制成合金作飞机制造业材料.
①家用铝锅 ②盛浓硝酸的容器 ③制导线 ④焊接钢轨 ⑤包装铝箔 ⑥制成合金作飞机制造业材料.
| A、只有①②③④ |
| B、只有④⑤⑥ |
| C、只有①③⑤⑥ |
| D、②④⑥ |
在无色透明的酸性溶液中能大量共存的离子组是( )
| A、K+、Cu2+、NO3-、SO42- |
| B、Na+、Ba2+、Cl-、SO42- |
| C、Na+、CO32-、Cl-、NO3- |
| D、Mg2+、K+、Ba2+、Cl- |
下列对化学反应的认识错误的是( )
| A、一定会伴随着化学键的变化 |
| B、不一定要遵循熵增加原理 |
| C、一定要遵循勒夏特勒原理 |
| D、一定要遵循能量守恒原理 |
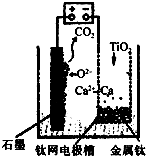 研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用如图所示装置获得金属钙,并以钙为还原剂,还原二氧化钛制备金属钛.下列叙述正确的是( )
研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用如图所示装置获得金属钙,并以钙为还原剂,还原二氧化钛制备金属钛.下列叙述正确的是( )| A、该电池工作过程中O2-向阴极移动 |
| B、阳极的电极反应式为C+2O2--4e-═CO2↑ |
| C、若用铅蓄电池作该装置的供电电源,“-”接线柱应连接PbO2电极 |
| D、在制备金属钛前后,整套装置中CaO的总量减少 |
下列反应的离子方程式错误的是( )
| A、氯气通入氢氧化钠溶液中 Cl2+2OH-=Cl-+ClO-+H2O |
| B、澄清石灰水中通入过量二氧化碳:Ca2++2OH-+CO2═CaCO3↓+H2O |
| C、在硅酸钠溶液中滴加稀硫酸SiO32-+2H+=H2SO3↓ |
| D、二氧化硅与烧碱溶液反应:SiO2+2OH-═SiO32-+H2O |