题目内容
19.下列有关物质性质的比较顺序中,不正确的是( )| A. | 微粒半径:Na+>Al3+>S2->Cl- | B. | 沸点:F2<Cl2<Br2<I2 | ||
| C. | 碱性:LiOH<NaOH<KOH<RbOH | D. | 熔点:Li>Na>K>Rb |
分析 A.具有相同电子层排布的离子,质子数越多半径越小,最外层电子数相同的离子,电子层数越多,半径越大;
B.相对分子质量越大,范德华力越大,分子晶体的沸点越高;
C.金属性越强,最高价氧化物对应的水化物碱性越强;
D.碱金属元素的单质,原子序数越大,熔沸点越低.
解答 解:A.具有相同电子层排布的离子,质子数越多半径越小,因此Na+>Al3+、S2->Cl-,最外层电子数相同的离子,电子层数越多,半径越大,所以微粒半径:S2->Cl->Na+>Al3+,故A错误;
B.相对分子质量越大,范德华力越大,分子晶体的沸点越高,因此沸点:F2<Cl2<Br2<I2,故B正确;
C.因为金属性Rb>K>Na>Li,金属性越强,最高价氧化物对应的水化物碱性越强,所以碱性:LiOH<NaOH<KOH<RbOH,故C正确;
D.碱金属元素的单质,原子序数越大,原子半径越大,熔沸点越低,则单质熔点:Li>Na>K>Rb,故D正确;
故选A.
点评 本题考查了微粒半径大小的比较、元素非金属性强弱判断、熔沸点的比较,题目难度不大,解题时关键是根据元素周期表和周期律判断出元素非金属性强弱.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.N2O俗称“笑气”,医疗上曾用作可吸入性麻醉剂,下列反应能产生N2O:3CO+2NO2=3CO2+N2O.下列关于N2O的说法一定正确的是( )
| A. | 上述反应中每生成1mol N2O,消耗67.2LCO | |
| B. | 等质量的N2O和CO2含有相等的电子数 | |
| C. | N2O只有氧化性,无还原性 | |
| D. | 上述反应中若有3 mol的CO被还原,则转移6NA个电子 |
7.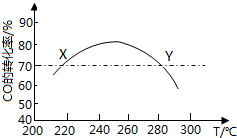 工业上,利用CO和H2合成二甲醚:3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)在合适的温度下,研究者进行了多次实验,每次实验保持原料气组成(3molCO、3molH2)、体积(10L)、反应时间等因素不变,实验结果如图所示.下列说法正确的是( )
工业上,利用CO和H2合成二甲醚:3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)在合适的温度下,研究者进行了多次实验,每次实验保持原料气组成(3molCO、3molH2)、体积(10L)、反应时间等因素不变,实验结果如图所示.下列说法正确的是( )
 工业上,利用CO和H2合成二甲醚:3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)在合适的温度下,研究者进行了多次实验,每次实验保持原料气组成(3molCO、3molH2)、体积(10L)、反应时间等因素不变,实验结果如图所示.下列说法正确的是( )
工业上,利用CO和H2合成二甲醚:3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)在合适的温度下,研究者进行了多次实验,每次实验保持原料气组成(3molCO、3molH2)、体积(10L)、反应时间等因素不变,实验结果如图所示.下列说法正确的是( )| A. | X、Y两点对应的CO正反应速率相等 | |
| B. | 合成二甲醚的正反应△H<0 | |
| C. | 反应温度应控制在260℃~280℃之间 | |
| D. | 选择合适催化剂,可以提高CO转化率 |
4.下列说法正确的是( )
| A. | 烷烃C5H12的同分异构体中,主链最短的一种系统命名为2,2-甲基丙烷 | |
| B. | 用酸性KMnO4 溶液可鉴别2-丁烯和正丁醛 | |
| C. | 由甘氨酸、丙氨酸形成的二肽有4种 | |
| D. | A、B两种有机化合物,无论以何种比例混合,只要混合物的总质量不变,完全燃烧后,产生水的质量也不变,则A、B满足的条件必须是最简式相同 |
8.下列物质属于纯净物的是( )
| A. | 漂白粉 | B. | 水玻璃 | C. | CuSO4•5H2O | D. | Fe(OH)3胶体 |