题目内容
15.某酸的化学式为HnA,某碱的化学式为M(OH)m.(1)若HnA为强酸,写出HnA在水中的电离方程式:HnA═nH++An-.
(2)若在室温下,0.1mol/L HnA溶液的pH大于1,HnA为弱酸(填“强酸”、“弱酸”或“不能确定”),n和1的关系为不能确定(填“>”、“<”、“=”或“不能确定”).
(3)室温下,若n=m,pH=2的HnA与pH=12的M(OH)m等体积混合后溶液呈酸性,则HnA为弱酸(填“强酸”、“弱酸”或“不能确定”);若n=m=1,则反应后溶液的离子浓度由小到大的顺序是c(OH-)<c(H+)<c(M+)<c(A-).
分析 (1)HnA是强酸,在水溶液中完全电离生成酸根离子和氢离子;
(2)0.1mol/L HnA溶液的pH大于1,说明溶液中的氢离子浓度小于0.1mol/L,n无论大于1还是小于1还是等于1,都说明该酸没有完全电离;
(3)室温下,若n=m,pH=2的HnA与pH=12的M(OH)m,酸中氢离子浓度等于碱中氢氧根离子浓度,等体积混合后溶液呈酸性,说明两种物质完全反应后酸有剩余,则酸浓度大于碱,为弱酸;
若n=m=1,溶液呈酸性则,c(OH-)<c(H+),根据电荷守恒判断c(M+)、c(A-)相对大小,酸的电离程度较小,据此分析解答.
解答 解:(1)HnA是强酸,在水溶液中完全电离生成酸根离子和氢离子,电离方程式为HnA═nH++An-,故答案为:HnA═nH++An-;
(2)0.1mol/L HnA溶液的pH大于1,说明溶液中的氢离子浓度小于0.1mol/L,n无论大于1还是小于1还是等于1,都说明该酸没有完全电离,故答案为:弱酸;不能确定;
(3)室温下,若n=m,pH=2的HnA与pH=12的M(OH)m,酸中氢离子浓度等于碱中氢氧根离子浓度,等体积混合后溶液呈酸性,说明两种物质完全反应后酸有剩余,则酸浓度大于碱,为弱酸;
若n=m=1,溶液呈酸性则,c(OH-)<c(H+),根据电荷守恒判断c(M+)、c(A-)相对大小,酸的电离程度较小,离子浓度顺序是c(OH-)<c(H+)<c(M+)<c(A-),
故答案为:弱酸;c(OH-)<c(H+)<c(M+)<c(A-).
点评 本题考查弱电解质的电离、离子浓度大小比较等知识点,侧重考查基本理论,明确混合溶液中的溶质及其性质结合溶液酸碱性判断离子浓度大小,难点是(3)题.

练习册系列答案
 字词句段篇系列答案
字词句段篇系列答案
相关题目
5.化学与生活、生产密切相关.下列叙述正确的是( )
| A. | 硅胶和铁粉常用于食品包装袋中作抗氧化剂,它们都是无机物 | |
| B. | 食盐和食醋常用于厨房中作调味品,它们都是盐 | |
| C. | 硅和石英常用于制作光导纤维,它们都是原子晶体 | |
| D. | 氢氧化铝和碳酸氢钠常用于消除胃酸过多,它们都是电解质 |
6.常温下,下列说法正确的是( )
| A. | 在(NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-) | |
| B. | 将pH=1的醋酸和pH=13的NaOH溶液等体积混合后的溶液c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| C. | 等体积等物质的量浓度的NaCl和CH3COONa两种溶液中离子总数:前者小于后者 | |
| D. | 等体积等物质的量浓度的HCl溶液和CH3COONa溶液混合后:c(CH3COOH)+c(CH3COO-)═c(Na+) |
10.a、b、c、d都是短周期元素,原子半径d>c>a>b,其中a、b处在同一周期,a、c处在同一主族.c原子核内质子数等于a、b原子核内质子数之和,c原子最外层上的电子数是d原子次外层电子数的一半.下列说法中正确的( )
| A. | a、c两元素处在元素周期表的VIA族 | |
| B. | b、d两种元素可组成化学式为d2b2的化合物,且阴阳离子个数比为1:2 | |
| C. | c单质可在b单质中燃烧生成的化合物的分子式为cb2 | |
| D. | c的单质可用来制作光导纤维 |
20.己知浓硝酸和乙胺反应:CH3CH2NH2+HNO3=CH3CH2NH3.NO3,产物 CH3CH2NH3•NO3的熔点为12℃,在室温下能够融化电离出CH3CH2NH3+和NO3-离子,称为室温离子.下列有关正确的是( )
| A. | 浓硝酸和乙胺反应属于加成反应 | |
| B. | 室溫离子可以使熔盐燃料电池在常溫下工作 | |
| C. | CH3CH2NO3中,只有σ键没有π键 | |
| D. | 融化CH3CH2•NO3晶体需要破坏分子间作用力 |
3.某X溶液可使甲基橙呈红色,在该溶液中可能含有K+、Fe2+、A13+、NH4+、CO32-、SO32-、SO42-、AlO2-、SiO32-、C1-中的若干种,现取X溶液进行连续实验,实验过程现象及产物如下,下列说法正确的是( )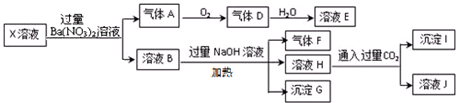

| A. | X中肯定存在Fe2+、A13+、NH4+、C1- | |
| B. | X中不能确定的离子是 K+和C1- | |
| C. | 沉淀G在空气中放置过程中,沉淀颜色会由白色变为灰绿色最后变为红褐色 | |
| D. | 标准状况下将一试管D气体倒扣在水槽中充分吸收(假设所得溶液没有扩散),所得溶液物质的量浓度约为0.036mol/L |
20.有四个系列同族元素形成的物质,101.3kP时测定它们的沸点(℃)如表所示:
对应表中内容,下列叙述中不正确的是( )
| ① | He-268.8 | (a)-249.5 | Ar-185.8 | Kr 151.7 |
| ② | F2 -187.0 | Cl2 -33.6 | (b) 58.7 | I2 184.0 |
| ③ | (c) 19.4 | HCl-84.0 | HBr-67.0 | HI-35.3 |
| ④ | H2O 100.0 | H2S-60.0 | (d)-42.0 | H2Te-1.8 |
| A. | a、b、c、d的化学式分别为Ne、Br2、HF、H2Se | |
| B. | 系列②中各物质均只有强氧化性 | |
| C. | 系列④中各化合物的稳定性顺序为:H2O>H2S>d>H2Te | |
| D. | 系列③中各物质对应物质水溶液的酸性和还原性均逐渐增强 |
1.化学与生产、生活密切相关,下列说法错误的是( )
| A. | 铝需经过特别处理才具有抗腐蚀能力 | |
| B. | 洁厕剂和漂白精不能混合使用,否则易产生有毒气体 | |
| C. | Li是最轻的金属也是活动性很强的金属,是制造电池的理想物质 | |
| D. | 只要符合限量,“食用色素”、“亚硝酸盐”可以作为某些食品的添加剂 |