题目内容
4.设NA为阿伏加德罗常数的值.下列说法正确的是( )| A. | 1.0 L 1.0 mo1•L-1的NaAlO2水溶液中含有的氧原子数为2NA | |
| B. | 56 g铁片投入足量浓H2SO4中生成NA个SO2分子 | |
| C. | 标准状况下,22.4 L氨水含有NA个NH3分子 | |
| D. | 常温常压下,14 g由N2与CO组成的混合气体含有的原子数目为NA |
分析 A、NaAlO2水溶液中除了NaAlO2本身,水也含氧原子;
B、铁在浓硫酸中会钝化;
C、标况下氨水为液态;
D、氮气和CO的摩尔质量均为28g/mol,且均为双原子分子.
解答 解:A、NaAlO2水溶液中除了NaAlO2本身,水也含氧原子,故溶液中的氧原子的个数大于2NA个,故A错误;
B、铁在浓硫酸中会钝化,反应程度很小,故生成的二氧化硫分子数小于NA个,故B错误;
C、标况下氨水为液态,不能根据气体摩尔体积来计算其物质的量,故C错误;
D、氮气和CO的摩尔质量均为28g/mol,故14g混合物的物质的量为0.5mol,而且两者均为双原子分子,故0.5mol混合物中含1mol原子即NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
14.下列各组中的离子,能在无色透明的溶液中大量共存的是( )
| A. | Mg2+、H+、Cl-、OH- | B. | Na+、Ba2+、CO${\;}_{3}^{2-}$、NO${\;}_{3}^{-}$ | ||
| C. | Na+、H+、Cu2+、SO${\;}_{4}^{2-}$ | D. | K+、Zn2+、NO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$ |
15.按图甲装置进行实验,若图乙中横坐标x表示通过电极的电子的物质的量.下列叙述正确的是( )


| A. | F表示反应生成Cu的物质的量 | B. | E表示反应生成O2的物质的量 | ||
| C. | E表示反应实际消耗H2O的物质的量 | D. | F表示反应生成H2SO4的物质的量 |
12.向H2SO4、CuCl2混合溶液中投入足量的铁粉,经充分反应后,过滤、洗涤、干燥、称重,知所得固体的质量与加入的铁粉的质量相等,则原溶液中c(SO42-)与c(Cl-)之比( )
| A. | 1:2 | B. | 1:7 | C. | 7:1 | D. | 1:14 |
19.下列操作能达到实验目的是( )
| A. | 向沸腾的NaOH溶液中滴加FeCl3饱和溶液制备Fe(OH)3胶体 | |
| B. | 加热除去碳酸氢钠中少量氯化铵 | |
| C. | 用镊子从煤油中取出金属钠,切下绿豆大小的钠,小心放入装满水的烧杯中,观察过氧化钠的颜色 | |
| D. | 用排四氯化碳法收集氨气、氯化氢 |
16.从分子的角度分析,下列解释错误的是( )
| A. | 空气是混合物--空气由不同种分子构成 | |
| B. | 热胀冷缩--分子的间隔随温度的改变而改变 | |
| C. | 电解水生成氢气和氧气--说明水中含有氢分子和氧分子 | |
| D. | 有同学在教室吃榴莲糖,整个教室都可以闻到榴莲味--分子在不断地运动 |
13.在Fe、Fe2+、Fe3+三种粒子中,具有相同的( )
| A. | 电荷数 | B. | 最外层电子数 | C. | 核电荷数 | D. | 核外电子数 |
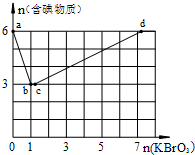 现向含6mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图所示.
现向含6mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量的关系如图所示.
 分子式:C12H10
分子式:C12H10 其苯环上的一氯代物有_5种
其苯环上的一氯代物有_5种 的系统命名是2,6-二甲基辛烷
的系统命名是2,6-二甲基辛烷 1mol该物质消耗5molH2,5molBr21molNa
1mol该物质消耗5molH2,5molBr21molNa