题目内容
10.已知反应:A(g)+Xb(g)?2C(g) 在一定温度下的密闭容器中充入等物质的量的气体A和B,达到平衡后,只改变反应的一个条件,测得容器内有关物质的浓度,反应速率随时间变化如图所示: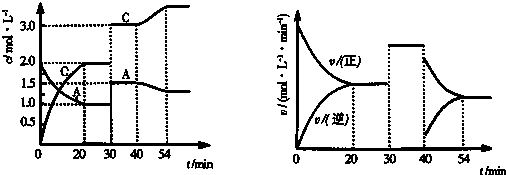
请回答下列问题:
(1)x=1.0-20min内平均速率v(B)=0.05mol/L•min当反应达到平衡状态时,v(B)正:v(C)逆=1:2
(2)在20min--30min时段内,该反应的化学平衡常数=4若20min,35min,55min时,反应的化学平衡常数分别为K1,K2,K3,则三者大小关系为:K1=K2<K3
(3)当反应生成2molC时,放热(填:放出或吸收)QKJ的热量,写出该反应的热化学方程式:A(g)+B(g)?2C(g)△H=-QKJ/mol.
分析 (1)由图象可知,30min时A、C的浓度瞬时增大相同的倍数,正、逆反应速率增大相同倍数,反应仍处于平衡状态,故不能是温度变化,而是压缩体积增大压强,平衡不移动,则1+X=2,故X=1,依据图象变化计算A的反应速率,不同物质表示的正逆速率之比等于化学计量数之比计算得到B的反应速率;
(2)化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,20~30 min改变的条件是降低压强,故25 min、35 min是温度相同,平衡常数相同,55min时A浓度减小,C浓度增大,平衡正向进行,说明改变的是温度变化;
(3)右图分析可知40min后反应速率减小,反应前后气体体积不变,左图中40min后反应正向进行,证明改变的是温度,并且是降低温度减小反应速率,平衡正向进行,正反应为放热反应.
解答 解:(1)由图象可知,30min时A、C的浓度瞬时增大相同的倍数,正、逆反应速率增大相同倍数,反应仍处于平衡状态,故不能是温度变化,而是压缩体积增大压强,平衡不移动,则1+X=2,故X=1,0-20min内平均速率V(A)=$\frac{2.0mol/L-1.0mol/L}{20min}$=0.05mol/L•min,不同物质表示的正逆速率之比等于化学计量数之比,v(B)=V(A)=0.05mol/L•min,当反应达到平衡状态时,v(B)正:v(C)逆=1:2;
故答案为:1,0.05mol/L•min,1:2;
(2)在20min--30min时段内,计算平衡浓度
A(g)+B(g)?2C(g)
起始量(mol/L) 2 2 0
变化量(mol/L) 1 1 2
平衡量(mol/L) 1 1 2
平衡常数k=$\frac{{c}^{2}(C)}{c(A)c(B)}$=$\frac{{2}^{2}}{1×1}$=4,
20~30 min改变的条件是降低压强,故25 min、35 min是温度相同,平衡常数相同,故K2=K1,55min时A浓度减小,C浓度增大,平衡正向进行,右图可知反应速率减小,说明改变的是温度变化,降低温度反应速率减小,平衡正向进行说明平衡常数K3增大,所以K1=K2<K3;
故答案为:4;K1=K2<K3;
(3)右图分析可知40min后反应速率减小,反应前后气体体积不变,左图中40min后反应正向进行,综合分析可知,改变的条件是改变温度,并且是降低温度减小反应速率,平衡正向进行,平衡移动原理推断正反应为放热反应,当反应生成2molC时放出QKJ的热量,则反应焓变为-QKJ/mol,反应的热化学方程式为:A(g)+B(g)?2C(g)△H=-QKJ/mol;
故答案为:放热;A(g)+B(g)?2C(g)△H=-QKJ/mol.
点评 本题考查化学平衡图象问题、化学平衡常数、热化学方程式书写、平衡状态特征等,题目难度中等,根据图象浓度的变化以及反应速率的变化判断化学反应状态以及影响反应速率的条件是,平衡常数计算和影响因素分析是解题关键,掌握基础是关键.

 阅读快车系列答案
阅读快车系列答案| A. | C的质量分数降低 | B. | 平衡向右移动 | C. | B的转化率升高 | D. | x+y<z |
| t/s | 0 | 500 | 1000 | 1500 |
| c(N2O5)mol/L | 5.00 | 3.52 | 2.50 | 2.50 |
| A. | 500s内N2O5分解速率为2.96×10-3 mol/(L•s) | |
| B. | T1温度下的平衡常数为K1=125,1000s时转化率为50% | |
| C. | 其他条件不变时,T2温度下反应到1000s时测得N2O5(g)浓度为2.98 mol/L,则T1<T2 | |
| D. | T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1>K2 |
| A. | 1mol/L Na2CO3溶液中的Na+数目为2NA | |
| B. | 1 mol Na与足量O2反应生成Na2O或Na2O2均失去NA电子 | |
| C. | 标准状况下,11.2LSO3所含分子数为0.5NA | |
| D. | 各5.6 g铁分别与足量的盐酸、氯气反应,电子转移总数均为0.3NA |
| A. | 丙烷的分子式是C3H6 | |
| B. | 丙烷分子中的碳原子在一条直线上 | |
| C. | 丙烷在光照条件下能够和氯气发生加成反应 | |
| D. | 丙烷的熔点比乙烷高 |
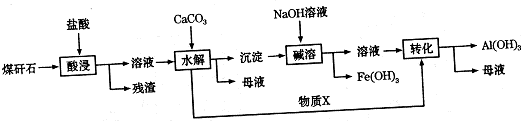
 有机反应中常用镍作催化剂.某镍催化剂中含Ni 64.0%、Al 24.3%、Fe 1.4%,其余为C、H、O、N等元素.
有机反应中常用镍作催化剂.某镍催化剂中含Ni 64.0%、Al 24.3%、Fe 1.4%,其余为C、H、O、N等元素.
 .
.