题目内容
12.请回答:(1)NH4Br的电子式
 .
.(2)工业上以氯气和石灰乳为原料制造漂白粉,化学方程式为2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O.
(3)实验室制备少量氢氧化钠:往石灰乳中加入碳酸钠溶液,过滤.写出该反应的离子方程式:Ca(OH)2+CO32-═CaCO3+2OH-
(4)双氧水能使酸性高锰酸钾溶液褪色,请完成以下相关反应的离子方程式:
2MnO4-+5H2O2+=2Mn2++8H2O+.
分析 (1)溴化铵为离子晶体,由铵根离子与溴离子通过离子键结合在一起;
(2)氯气和石灰乳反应生成氯化钙、次氯酸钙和水;
(3)碳酸钠与氢氧化钙反应生成碳酸钙和氢氧化钠,碳酸钠为易溶于水易电离的物质,石灰乳为悬浊液离子反应中应写化学式;
(4)根据氧化还原反应中得失电子数相等和质量守恒配平.
解答 解:(1)溴化铵是离子化合物,由铵根离子与溴离子构成,电子式为: ,
,
故答案为: ;
;
(2)以氯气和石灰乳为原料制造漂白粉,反应生成CaCl2、Ca(ClO)2、H2O,该反应为2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O,
故答案为:2Cl2+2Ca(OH)2═CaCl2+Ca(ClO)2+2H2O;
(3)碳酸钠与氢氧化钙反应生成碳酸钙和氢氧化钠,碳酸钠、氢氧化钠拆成离子,离子反应为:Ca(OH)2+CO32-═CaCO3+2OH-,
故答案为:Ca(OH)2+CO32-═CaCO3+2OH-;
(4)双氧水中氧元素的化合价从-1价升高到0价,失去1个电子.而高锰酸钾中锰元素的化合价从+7价降低到+2价,得到2个电子,所以根据电子的得失守恒可知,配平后的反应为2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑,
故答案为:2;5;6H+;2;8;5O2↑.
点评 本题考查了电子式、化学方程式的书写,注意掌握电子式的概念及表示方法,氧化还原反应应把握反应中元素的化合价变化为解答的关键,侧重分析、应用能力的考查,题目难度不大.

练习册系列答案
 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
2.下列有关高分子化合物的说法不正确的是( )
| A. | 丙烯(CH3CH=CH2)在一定条件下加聚后可得聚丙烯: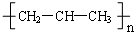 | |
| B. | 某塑料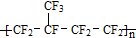 可由CF2=CF2和CF2=CFCF3通过加聚反应制得 可由CF2=CF2和CF2=CFCF3通过加聚反应制得 | |
| C. | 合成高分子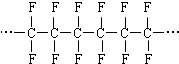 的单体是CF2=CF2 的单体是CF2=CF2 | |
| D. | 一种全降解塑料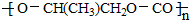 可由 可由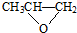 和 CO2在催化剂作用下加聚生成 和 CO2在催化剂作用下加聚生成 |
3.化学与人类生活、生产和社会可持续发展密切相关,下列说法不正确的是( )
| A. | 2016年9月“G20”峰会即将在杭州举行,为了给外国友人一个美好蓝天,全国各地各化工企业推进脱硫、脱硝、除尘等设施改造,能大量减排SO2、NO2,使天空重现“APEC蓝” | |
| B. | 视频《穹顶之下》再次引起公众对“PM2.5”的关注.“PM2.5”是指大气中直径小于或等于2.5×10-6m的细小颗粒物,这些颗粒扩散在空气中形成胶体 | |
| C. | 有机玻璃是以有机物A(甲基丙烯酸甲酯)为单体,通过加聚反应得到的,合成A的一种途径是:CH3C≡CH+CO+CH3$\stackrel{pd}{OH}$→CH2≡(CH3)COOCH3,其过程符合绿色化学的原则 | |
| D. | 近期在西非国家爆发的埃博拉疫情呈加速蔓延之势,已知该病毒对化学药品敏感,双氧水、“84”消毒液均可以将病毒氧化而达到消毒的目的 |
7.化学与科学技术、社会经济和生态环境的协调发展息息相关,下列有关说法不正确的是( )
| A. | 环保太阳能公厕已在多地投入使用,其顶部的太阳能电池板可将太阳能转变成电能和热能 | |
| B. | 我国已能利用3D打印技术,以钛合金粉末为原料,通过激光熔化逐层堆积,来制造飞机钛合金结构件,高温时可用金属钠还原相应的氯化物来制取金属钛 | |
| C. | 汽车尾气中的氮氧化物和碳氢化合物在大气环境中受强烈的太阳紫外线照射后产生一种新的二次污染物-光化学烟雾也会引起雾霾,汽车尾气中含有氮氧化物,原因是汽油燃烧不充分 | |
| D. | 生物炼铜法就是利用某种能耐受铜盐毒性的细菌,利用空气中的氧气把不溶性的硫化铜转化为可溶性的铜盐,从而使铜的冶炼变得成本低,污染小,反应条件十分简单 |
17.某化学探究小组拟用废铜屑制取Cu(NO3)2,并探究其化学性质.
I.如图1,用浓HNO3,和过量的废铜屑充分反应制硝酸铜溶液.
(1)写出铜与浓硝酸反应的离子方程式Cu+4H++2NO3-=Cu2++2NO2↑+2H2O.
(2)①装置中NaOH溶液的作用是吸收氮氧化物,防止污染空气.
②欲从反应后的溶液中得到硝酸铜晶体,实验操作步骤是蒸发浓缩、冷却结晶、过滤.
③你认为此装置是否合理,并说明原因不合理,密闭体系中立即产生大量气体,会有安全隐患;或者合理,慢慢挤压,胶头滴管控制反应速率,使NaOH溶液及时吸收NO2.
如果不合理,同时在原装置上改进;如果合理,只需说明原因.
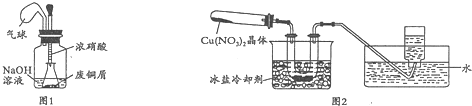
Ⅱ.为了探究Cu(NO3)2的热稳定性,探究小组按图2装置进行实验.(图中铁架台、铁夹和加热仪器均略去)
【实验装置】
【实验操作及现象】往试管中放入研细的无水Cu(NO3)2晶体并加热,观察到试管中有红棕色气体生成,最终残留黑色粉末;用U型管除去红棕色气体,在集气瓶中收集到无色气体.
【解释与结论】
(3)①红棕色气体是NO2.
②根据现象判断Cu(NO3)2在加热条件下可以分解,其化学反应方程式为2Cu(NO3)2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+4NO2↑+O2↑.
Ⅲ.利用Cu(NO3)2制备浅绿色的碱式碳酸铜[CuCO3•Cu(OH)2].
向大试管中加入一定量的碳酸钠溶液和硝酸铜溶液,水浴加热,用0.4mol•L-1的NaOH溶液调节pH至8.5,振荡、静置、过滤、洗涤、干燥,得到样品.
【实验数据】反应温度对样品的影响
(4)滤液中可能含有CO32-,写出检验CO32-的方法取少量滤液置于试管中,加入足量稀盐酸,将产生的气体通入澄清石灰水,溶液变浑浊,说明含碳酸根离子.
(5)95℃时,样品颜色发暗的原因:含有黑色的氧化铜.
(6)70℃时,实验得到2.38g样品,取此样品加热至分解完全(杂质不分解),得到1.76g固体,此样品中碱式碳酸铜的质量分数是93.3%.
I.如图1,用浓HNO3,和过量的废铜屑充分反应制硝酸铜溶液.
(1)写出铜与浓硝酸反应的离子方程式Cu+4H++2NO3-=Cu2++2NO2↑+2H2O.
(2)①装置中NaOH溶液的作用是吸收氮氧化物,防止污染空气.
②欲从反应后的溶液中得到硝酸铜晶体,实验操作步骤是蒸发浓缩、冷却结晶、过滤.
③你认为此装置是否合理,并说明原因不合理,密闭体系中立即产生大量气体,会有安全隐患;或者合理,慢慢挤压,胶头滴管控制反应速率,使NaOH溶液及时吸收NO2.
如果不合理,同时在原装置上改进;如果合理,只需说明原因.

Ⅱ.为了探究Cu(NO3)2的热稳定性,探究小组按图2装置进行实验.(图中铁架台、铁夹和加热仪器均略去)
【实验装置】
【实验操作及现象】往试管中放入研细的无水Cu(NO3)2晶体并加热,观察到试管中有红棕色气体生成,最终残留黑色粉末;用U型管除去红棕色气体,在集气瓶中收集到无色气体.
【解释与结论】
(3)①红棕色气体是NO2.
②根据现象判断Cu(NO3)2在加热条件下可以分解,其化学反应方程式为2Cu(NO3)2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+4NO2↑+O2↑.
Ⅲ.利用Cu(NO3)2制备浅绿色的碱式碳酸铜[CuCO3•Cu(OH)2].
向大试管中加入一定量的碳酸钠溶液和硝酸铜溶液,水浴加热,用0.4mol•L-1的NaOH溶液调节pH至8.5,振荡、静置、过滤、洗涤、干燥,得到样品.
【实验数据】反应温度对样品的影响
| 实验序号 | 1 | 2 | 3 | 4 |
| 温度/℃ | 35 | 50 | 70 | 95 |
| 样品颜色 | 深蓝色 | 深蓝色 | 浅绿色 | 暗蓝色 |
| 样品中碱式碳酸铜的质量分数/% | 90.9 | 92.7 | x | 92.0 |
(5)95℃时,样品颜色发暗的原因:含有黑色的氧化铜.
(6)70℃时,实验得到2.38g样品,取此样品加热至分解完全(杂质不分解),得到1.76g固体,此样品中碱式碳酸铜的质量分数是93.3%.
4.以下说法正确的是( )
| A. | 萃取碘水中的碘时,将碘水倒入分液漏斗,然后再注入酒精,震荡静置后下层液体下口出,上层液体上口出 | |
| B. | 在蔗糖溶液中加入几滴稀硫酸,水浴加热5 min,加入NaOH溶液至碱性,再加入银氨溶液并水浴加热 | |
| C. | 将Fe(NO3)2固体溶于稀硫酸后,滴加KSCN溶液,溶液变红,说明已经Fe(NO3)2变质 | |
| D. | 提纯混有少量硝酸钾的氯化钠,应采用在较高温度下制得浓溶液再冷却结晶、过滤干燥 |
 铁是日常生活中用途最广、用量最大的金属材料.
铁是日常生活中用途最广、用量最大的金属材料. 在酸性条件下水解后生成的有机物为
在酸性条件下水解后生成的有机物为 和CH3OH.
和CH3OH.