题目内容
3.某种飞船以N2H4和N2O4为动力源,发生反应:2N2H4+N2O4═3N2↑+4H2O,反应温度可高达2700℃,若有1mol N2H4被氧化,则下列判断不正确的是( )| A. | 生成33.6LN2(标准状况下) | B. | 被还原的N原子的物质的量为2mol | ||
| C. | 转移电子的物质的量为4 mol | D. | 还原产物比氧化产物多0.5mol |
分析 该反应中N元素化合价由-2价、+4价变为0价,所以N2H4被氧化,N2O4被还原,N2既是氧化产物又是还原产物,当有1 mol N2H4被氧化,则有0.5 mol N2O4被还原,同时有1.5mol氮气生成.
A.根据V=nVm计算生成氮气体积;
B.N2O4中N原子被还原;
C.根据肼和转移电子之间的关系式计算转移电子物质的量;
D.还原产物是氧化剂对应的产物、氧化产物是还原剂对应的产物,若有1mol N2H4被氧化,则氧化产物的物质的量是1mol,还原产物的物质的量是0.5mol.
解答 解:该反应中N元素化合价由-2价、+4价变为0价,所以N2H4被氧化,N2O4被还原,N2既是氧化产物又是还原产物,当有1 mol N2H4被氧化,则有0.5 mol N2O4被还原,同时有1.5mol氮气生成.
A.生成标准状况下氮气体积=1.5mol×22.4L/mol=33.6 L,故A正确;
B.当有1 mol N2H4被氧化,则有0.5 mol N2O4被还原,则被还原N原子物质的量=0.5mol×2=1mol,故B错误;
C.当有1 mol N2H4被氧化,转移电子的物质的量=1mol×2×[0-(-2)]=4 mol,故C正确;
D.还原产物是氧化剂对应的产物、氧化产物是还原剂对应的产物,若有1mol N2H4被氧化,则氧化产物的物质的量是1mol,还原产物的物质的量是0.5mol,所以氧化产物比还原产物多0.5 mol,故D错误.
故选BD.
点评 本题考查氧化还原反应有关计算,侧重考查基本计算及基本概念,明确各个物理量之间关系及基本概念判断方法是解本题关键,题目难度不大.

练习册系列答案
相关题目
11.赫克反应、根岸反应和铃木反应已成为化学家们制造复杂化学分子的“精致工具”,在科研、医药和电子等领域经广泛应用.下面是由铃木反应合成出来的一种联苯的衍生物,(用字母“K”表示),下列叙述正确的是( )


| A. | “K”属于芳香烃 | |
| B. | “K”的苯环上的一硝基取代产物有5种 | |
| C. | “K”中含有三种官能团 | |
| D. | 11mol“K”最多可和6molH2发生加成反应 |
8.如图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,下列有关说法中不正确的是( )


| A. | 该能量转化系统中的水也是可以循环的 | |
| B. | 燃料电池放电时的负极反应:H2-2e-+2OH-═2H2O | |
| C. | 水电解系统中的阳极反应:4OH--4e-═2H2O+O2↑ | |
| D. | 燃料电池系统产生的能量实际上来自于水 |
15.等物质的量的下列烃完全燃烧,消耗的氧气最多的是( )
| A. | CH4 | B. | C2H6 | C. | C3H8 | D. | C4H10 |

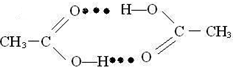 .
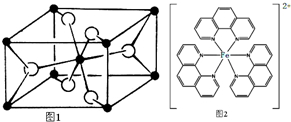
.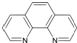 ),它能与Fe2+形成红色配合物(如右图2),
),它能与Fe2+形成红色配合物(如右图2),