题目内容
11.下列解释事实的化学用语正确的是( )| A. | CO2的水溶液显酸性:CO2+H2O?H2CO3?2H++CO32- | |
| B. | Na2S2O3溶液与稀H2SO4混合产生黄色浑浊:Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O | |
| C. | 氢氧化亚铁能与次氯酸反应:Fe(OH)2+2H++2ClO-=Fe2++2H2O+2Cl- | |
| D. | 草酸是二元弱酸,能使酸性高锰酸钾溶液褪色:2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O |
分析 A.碳酸为二元弱酸,其电离方程式分步书写,主要以第一步为主;
B.Na2S2O3溶液在酸性条件下反应生成二氧化硫气体和硫单质;
C.次氯酸不能拆开,二者发生氧化还原反应生成氢氧化铁沉淀;
D.草酸为二元弱酸,离子方程式中草酸不能拆开.
解答 解:A.CO2的水溶液显酸性,正确的反应为:CO2+H2O?H2CO3?H++HCO3-,故A错误;
B.Na2S2O3溶液与稀H2SO4混合产生硫单质,发生反应为:Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O,故B正确;
C.氢氧化亚铁能与次氯酸发生氧化还原反应,正确的离子方程式为:6Fe(OH)2+3HClO=5Fe(OH)3+Fe3++3Cl-,故C错误;
D.草酸是二元弱酸,能使酸性高锰酸钾溶液褪色,草酸不能拆开,正确的离子方程式为:2MnO4-+6H++5H2C2O4=2Mn2++10CO2↑+8H2O,故D错误;
故选B.
点评 本题考查了离子方程式的判断,题目难度不大,注意掌握离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等;C为易错点,注意次氯酸酸性减弱,不会溶解氢氧化铁,且二者发生氧化还原反应.

练习册系列答案
相关题目
1.已知二羟甲戊酸(如图)是生物合成青蒿素的原料之一.下列关于二羟甲戊酸的说法正确的是( )


| A. | 二羟甲戊酸的分子式为C6H10O4 | |
| B. | 1mol二羟甲戊酸与足量的Na钠反应生成1mol H2 | |
| C. | 二羟甲戊酸与乙醇、乙酸均能发生酯化反应 | |
| D. | 二羟甲戊酸不能使酸性KMnO4溶液褪色 |
2.下列关于漂白粉的叙述正确的是( )
| A. | 有效成分是CaCl2 | B. | 空气中久置会变质 | ||
| C. | 工业上常用Cl2和消石灰反应制得 | D. | 使用时加浓盐酸可提高漂白效果 |
19. 将气体X通入溶液A(如图,尾气吸收装置略)中,实验现象能够支持结论的是( )
将气体X通入溶液A(如图,尾气吸收装置略)中,实验现象能够支持结论的是( )
 将气体X通入溶液A(如图,尾气吸收装置略)中,实验现象能够支持结论的是( )
将气体X通入溶液A(如图,尾气吸收装置略)中,实验现象能够支持结论的是( ) | 选项 | 气体X | 溶液A及反应现象 | 结论 |
| A. | 乙醇与浓硫酸共热170℃产生的气体 | Br2的水溶液由橙黄色变为无色 | 乙烯与溴发生加成反应 |
| B. | 二氧化锰与浓盐酸共热产生的气体 | 紫色石蕊溶液最终褪色 | 氯气与水反应生成具有漂白性的物质 |
| C. | 碳酸钠固体与醋酸溶液反应产生的气体 | Na2SiO3溶液中出现白色沉淀 | 碳酸的酸性强于硅酸 |
| D. | 电石与饱和食盐水反应产生的气体 | KMnO4酸性溶液紫色逐渐变浅 | 乙炔被高锰酸钾酸性溶液氧化 |
| A. | A | B. | B | C. | C | D. | D |
6.下列排列顺序不正确的是( )
| A. | 原子半径:Na<Al | B. | 热稳定性:HF>NH3 | ||
| C. | 碱性:NaOH>Mg(OH)2 | D. | 酸性:H2SO4>H3PO4 |
16.常温常压下,下列化合物以气态形式存在的是( )
| A. | 甲醛 | B. | 乙醇 | C. | 苯酚 | D. | 乙酸乙酯 |
3.下列对氨基酸和蛋白质的描述不正确的是( )
| A. | 蛋白质水解的最终产物是氨基酸 | |
| B. | 采用多次盐析和溶解,可以分离提纯蛋白质 | |
| C. | 鸡蛋清溶液中滴入浓硝酸微热有黄色沉淀生成 | |
| D. | H2N-CH2-COOH与  混合物脱水只生成2种二肽 混合物脱水只生成2种二肽 |
20.下列物质中,既能与盐酸反应,又能与氢氧化钠溶液反应的是( )
①NaHSO4②Al2O3 ③NaHSO3 ④AgNO3.
①NaHSO4②Al2O3 ③NaHSO3 ④AgNO3.
| A. | ②③④ | B. | ①②③④ | C. | ②③ | D. | ①②③ |
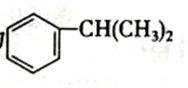
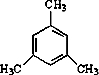 (填结构简式).
(填结构简式).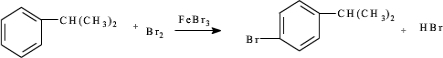 .
.