题目内容
12.胶体是一种重要的分散系.(1)向胶体中加入电解质能使胶体凝聚.使一定量的胶体在一定时间内开始凝聚所需电解质的物质的量浓度,称作“聚沉值”,电解质的“聚沉值”越小,则表示其“凝聚值”越大(填“越小”或“越大”).实验证明,凝聚能力主要取决于与胶体粒子带相反电荷的离子所带的电荷数,电荷数越大,凝聚能力越大.向Fe(OH)3胶体中加入下列电解质时,其“聚沉值”最小的是④(填序号)
①NaCl ②FeCl3 ③K2SO4 ④Na3PO4
(2)为了把黏土溶胶(黏土溶胶粒子带负电荷)变成较洁净的水,加入等物质的量的下列电解质时,哪种效果最明显?B(填编号,下同);原因是等物质的量的这四种电解质中,Al2(SO4)3的阳离子所带电荷的物质的量最大,凝聚能力越大,效果最好
A.BaCl2 B.Al2(SO4)3 C.KCl D.CuSO4
(3)向胶体中加入某种溶液,出现沉淀,继续滴加该溶液后沉淀溶解,滴入的溶液可能是B.
A.NaOH溶液 B.稀H2SO4 C.Na2SO4溶液 D.乙醇
(4)区分胶体和溶液常用的方法叫做丁达尔效应,这是因为胶体粒子对光线散射作用而形成的.
分析 (1)由题目信息,使一定量的胶体在一定时间内开始凝聚所需电解质的物质的量浓度,称作“聚沉值”,当所需的电解质的浓度越小即聚沉值越小时时,说明其凝聚能力越大;胶体的凝聚能力主要决定于胶粒带相反电荷的离子所带的电荷数,因Fe(OH)3胶体粒子带正电荷,则加入电解质的阴离子所带电荷数越多,其聚沉能力越大,聚沉值越小.
(2)凝聚能力主要取决于与胶粒带相反电荷的离子所带的电荷数,电荷数越大,凝聚能力越大.黏土胶体微粒带负电荷,故凝聚效果取决于阳离子所带的电荷数,据此计算.
(3)根据胶体的聚沉及氢氧化铁的性质分析;
(4)胶体和溶液是不同的分散系,胶体有丁达尔效应溶液没有.
解答 解:(1)使一定量的胶体在一定时间内开始凝聚所需电解质的物质的量浓度,称作“聚沉值”,当所需的电解质的浓度越小即聚沉值时,说明其凝聚能力越大;Fe(OH)3胶体粒子带正电荷,故加入的阴离子可以相互中和电性,减小同种电性相互排斥而使之聚沉.依据题意,阴离子所带的负电荷数越大,聚沉能力越大,“聚沉值”越小.
①NaCl中一个氯离子带一个负电荷,故①不符合;
②FeCl3中一个氯离子带一个负电荷,故②不符合;
③K2S04中一个硫酸根离子带2个负电荷,故③不符合;
④Na3P04中一个磷酸根离子带3个负电荷,故④符合;
故答案为:越大;④;
(2)凝聚能力主要取决于与胶粒带相反电荷的离子所带的电荷数,电荷数越大,凝聚能力越大,黏土胶体微粒带负电荷,故凝聚效果取决于阳离子所带的电荷数,设物质的量为1mol,
A、BaCl2 的物质的量1mol,含有的阳离子所带的电荷的物质的量1mol×1×2=2mol;
B、Al2(SO4)3物质的量1mol,含有的阳离子所带的电荷的物质的量1mol×2×3=6mol;
C、KCl物质的量1mol,含有的阳离子所带的电荷的物质的量1mol×1×1=1mol;
D、CuSO4的物质的量1mol,含有的阳离子所带的电荷的物质的量1mol×1×2=2mol;
等物质的量的这四种电解质中,Al2(SO4)3的阳离子所带电荷的物质的量最大,凝聚能力越大,效果最好,故选B.
故答案为:B;等物质的量的这四种电解质中,Al2(SO4)3的阳离子所带电荷的物质的量最大,凝聚能力越大,效果最好;
(3)向制得Fe(OH)3 胶体中加入硫酸,胶体会发生聚沉,Fe(OH)3能溶于硫酸,所以沉淀又消失,沉淀溶解的离子方程式为:Fe(OH)3+3H+=Fe3++3H2O;
故答案为:B;
(4)胶体具有丁达尔效应,这是因为胶体粒子对光线的散射作用而形成的,区分胶体和溶液常用的方法叫做丁达尔效应,
故答案为:丁达尔效应;散射.
点评 本题考查了胶体的重要的性质以及胶体的聚沉值的计算,注意题目信息的提取,难度不大.

| A. | 所含共用电子对数目为($\frac{m}{7}$+1)NA | B. | 所含碳氢键数目为$\frac{m{N}_{A}}{7}$ | ||
| C. | 燃烧时消耗的O2一定是33.6m/14 L | D. | 所含原子总数为$\frac{m{N}_{A}}{14}$ |
| A. | 按系统命名法,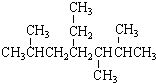 的名称为2,5,6-三甲基-4-乙基庚烷 的名称为2,5,6-三甲基-4-乙基庚烷 | |
| B. | 常压下,正戊烷、异戊烷、新戊烷的沸点依次增大 | |
| C. | 相同质量的烃,完全燃烧,消耗O2越多,烃中含ω(H)越高 | |
| D. | 乙烯和甲烷可用溴的四氯化碳溶液鉴别 |
| A. | CO2和CH4都是引起“温室效应”的气体 | |
| B. | Na2O、Na2O2的组成元素相同,但阳离子和阴离子的数目比不同 | |
| C. | SO2、NO、NO2都是大气污染气体,在空气中都能稳定存在 | |
| D. | 分别向新制氯水和久置氯水中滴加少量紫色石蕊试液,充分振荡后溶液都呈红色 |
| A. | MgCl2 | B. | Mg(OH)2 | C. | MgO | D. | Mg |