题目内容
向紫色石蕊溶液中加过量的Na2O2粉末,振荡,正确的叙述是( )
| A、溶液仍为紫色 |
| B、最后溶液变为蓝色且有气泡产生 |
| C、最后溶液退色 |
| D、振荡后向其中加入FeCl2溶液一定不会出现红褐色沉淀 |
考点:钠的重要化合物
专题:元素及其化合物
分析:过氧化钠与水反应生成NaOH和氧气,并且Na2O2具有强氧化性,能使紫色溶液褪色,以此解答.
解答:
解:过氧化钠与水反应的化学方程式为2Na2O2+2H2O═4NaOH+O2↑,溶液中有气泡产生,过氧化钠过量,且有强氧化性,能使紫色石蕊溶液因氧化而褪色,溶液最终变为无色.振荡后向其中加入FeCl2溶液,生成Fe(OH)3红褐色沉淀,
故选C.
故选C.
点评:本题考查过氧化钠的性质,为高频考点,侧重于学生的分析能力的考查,题目难度不大,注意过氧化钠能使紫色溶液褪色的性质.

练习册系列答案
 作业辅导系列答案
作业辅导系列答案
相关题目
为除去某物质中所含的杂质,所选用的试剂或操作方法正确的是( )
| 序号 | 物质 | 杂质 | 除杂质应选用的试剂或操作方法 |
| ① | KNO3溶液 | KOH | 滴入稀盐酸,同时用PH计测定至溶液呈中性 |
| ② | FeSO4溶液 | CuSO4 | 加入过量铁粉并过滤 |
| ③ | H2 | CO2 | 依次通过盛有NaOH溶液和浓硫酸的洗气瓶 |
| ④ | Na2SO4 | CaCO3 | 溶解、过滤、蒸发、结晶 |
| A、①②③ | B、②③④ |
| C、①③④ | D、①②③④ |
下列药品若用氯气消毒过的自来水来配制,会变质的是( )
| A、Na2SO4 |
| B、NaCl |
| C、AgNO3 |
| D、K2CO3 |
下列各组离子能大量共存的是( )
| A、Na+ NH4+ S2- AlO2- |
| B、Fe3+ K+ HSO3- Cl- |
| C、NH4+ Ca2+ HCO3-AlO2- |
| D、Fe2+ Mg2+ SO42- NO3- |
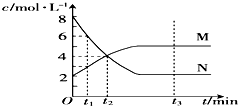 在一定温度下,容器内某一反应中M、N的物质的量浓度随反应时间变化的曲线如图.则下列表述中正确的是( )
在一定温度下,容器内某一反应中M、N的物质的量浓度随反应时间变化的曲线如图.则下列表述中正确的是( )| A、该反应的化学方程式为2N?M |
| B、t1时,M的浓度是N浓度的2倍 |
| C、t3时,正反应速率大于逆反应速率 |
| D、t2时,正、逆反应速率相等,化学反应达到了平衡 |
以下实验基本操作正确的是( )
A、 加热液体 |
B、 测定溶液pH |
C、 称量固体 |
D、 稀释浓硫酸 |
下列事实中,不能用勒夏特列原理解释的是( )
| A、Fe(SCN)3溶液中加入固体KSCN后颜色变深 |
| B、向稀盐酸中加入少量蒸馏水,盐酸中氢离子浓度降低 |
| C、实验室常用排饱和食盐水的方法收集氯气 |
| D、棕红色NO2加压后颜色先变深后变浅 |
设NA为阿伏加德罗常数的值.下列说法不正确的是( )
| A、常温下,30 g的2-丙醇中含有羟基的数目为0.5 NA |
| B、15g C2H6含C-H键数目为3NA |
| C、28g乙烯与丙烯的混合气体,含碳原子总数为2NA |
D、7.8g 中含有的碳碳双键数目为0.3NA 中含有的碳碳双键数目为0.3NA |
