题目内容
8.恒温恒容下,向2L密闭容器中加入MgSO4(s)和CO(g),发生反应:MgSO4(s)+CO(g)?MgO(s)+CO2(g)+SO2(g)反应过程中测定的部分数据见表:
| 反应时间/min | n(MgSO4)/mol | n(CO)/mol | n(CO2)/mol |
| 0 | 2.00 | 2.00 | 0 |
| 2 | 0.80 | ||
| 4 | 1.20 |
| A. | 反应在0~2min内的平均速率为v(SO2)=0.6 mol•L-1•min-1 | |
| B. | 反应在2~4min内容器内气体的密度没有变化 | |
| C. | 若升高温度,反应的平衡常数变为1.00,则正反应为放热反应 | |
| D. | 保持其他条件不变,起始时向容器中充入1.00mol MgSO4和1.00molCO,到达平衡时n(CO2)>0.60mol |
分析 A.由表中数据,可知2min内△n(CO)=2mol-0.8mol=1.2mol,由方程式可知△n(SO2)=△n(CO)=1.2mol,再根据v=$\frac{△c}{△t}$计算v(SO2);
B.2min时消耗CO为1.2mol,由方程式可知△n(CO2)=△n(CO)=1.2mol,4min时CO2为1.2mol,说明2min、4min处于平衡状态;
C.平衡时c(SO2)=c(CO2)=$\frac{1.2mol}{2L}$=0.6mol/L,c(CO)=$\frac{0.8mol}{2L}$=0.4mol/L,则平衡常数K=$\frac{0.6×0.6}{0.4}$=0.9,若升高温度,反应的平衡常数变为1.00,大于原温度下平衡常数K=0.9,说明升高温度平衡正向移动;
D.等效为在原平衡基础上减小压强,平衡正向移动,CO转化率大于原平衡.
解答 解:A.由表中数据,可知2min内△n(CO)=2mol-0.8mol=1.2mol,由方程式可知△n(SO2)=△n(CO)=1.2mol,则v(SO2)=$\frac{\frac{1.2mol}{2L}}{2min}$=0.3mol/(L.min),故A错误;
B.2min时消耗CO为1.2mol,由方程式可知△n(CO2)=△n(CO)=1.2mol,4min时CO2为1.2mol,说明2min、4min处于平衡状态,故反应在2~4min内容器内气体的密度没有变化,故B正确;
C.平衡时c(SO2)=c(CO2)=$\frac{1.2mol}{2L}$=0.6mol/L,c(CO)=$\frac{0.8mol}{2L}$=0.4mol/L,则平衡常数K=$\frac{0.6×0.6}{0.4}$=0.9,若升高温度,反应的平衡常数变为1.00,大于原温度下平衡常数K=0.9,说明升高温度平衡正向移动,升高温度平衡向吸热反应移动,故正反应为吸热反应,故C错误;
D.保持其他条件不变,起始时向容器中充入1.00mol MgSO4和1.00molCO,等效为在原平衡基础上减小压强,平衡正向移动,CO转化率大于原平衡,则到达平衡时n(CO2)>0.60mol,故D正确,
故选:BD.
点评 本题考查化学平衡计算,涉及反应速率计算、平衡常数应用与影响因素,侧重考查学生对数据的分析处理能力,注意掌握平衡常数的应用,难度中等.

 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案| A. |  | B. |  | C. |  | D. |  |
| A. | 合金:都具有金属特性和固定的熔点 | |
| B. | 金属延展性:金属受外力发生形变,但金属键没有被破坏 | |
| C. | 金属导热性:金属内自由电子传递热量 | |
| D. | 用钢材作建材而不是纯铁:钢材的硬度一般比纯铁的硬度大 |

(1)图Ⅰ是1mol NO2(g)和1mol CO(g)反应生成1mol CO2(g)和1mol NO(g)过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是减小(填“增大”、“减小”或“不变”,下同),△H的变化是不变.请写出NO2和CO反应的热化学方程式:NO2 (g)+CO (g)═CO2 (g)+NO (g)△H=-234 kJ•mol-1.
(2)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应热化学方程式如下:
①CH3OH(g)+H2O(g)═CO2(g)+3H2(g)△H=+49.0kJ•mol-1
②CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)△H=-192.9kJ•mol-1
又知③H2O(g)═H2O(l)△H=-44kJ•mol-1,则甲醇蒸汽燃烧为液态水的热化学方程式为CH3OH (g)+$\frac{3}{2}$O2 (g)═CO2 (g)+2 H2O (l)△H=-764.7 kJ•mol-1.
(3)如表所示是部分化学键的键能参数:
| 化学键 | P-P | P-O | O═O | P═O |
| 键能/kJ•mol-1 | a | b | c | x |
| A. | 反应开始后,反应要放出能量 | |
| B. | 建立平衡状态时c(N2)<3 mol/L | |
| C. | 该条件下,平衡时N2的体积分数为$\frac{1}{14}$ | |
| D. | 反应条件变化时,其K值也一定发生变化 |

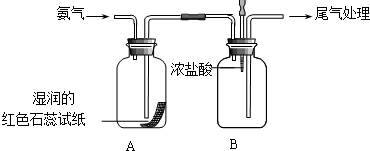 某小组同学利用如图所示装置探究氨气的性质.
某小组同学利用如图所示装置探究氨气的性质.