题目内容
 某化学兴趣小组为了测定某草酸晶体的纯度设计了如下实验.化学反应如下:KMnO4+H2C2O4+H2SO4-K2SO4+MnSO4+CO2↑+H2O(未配平)实验主要步骤如下:
某化学兴趣小组为了测定某草酸晶体的纯度设计了如下实验.化学反应如下:KMnO4+H2C2O4+H2SO4-K2SO4+MnSO4+CO2↑+H2O(未配平)实验主要步骤如下:Ⅰ、称取2.80g草酸晶体(H2C2O4?2H2O)配成100mL草酸溶液
Ⅱ、取25.00ml草酸溶液于锥形瓶中,加入适量稀硫酸,用0.1000mol?L-1酸性高锰酸钾溶液滴定,消耗KMnO4溶液20.00mL
根据上述实验步骤请回答下列问题:
(1)高锰酸钾溶液应盛装于
(2)滴定到达终点的判断标志是:
(3)下列造成草酸晶体质量分数偏高的是
A、滴定终点读数时俯视 B、滴定前有气泡,滴定后气泡消失
C、润洗锥形瓶 D、滴定过程中加入少量蒸馏水冲洗瓶壁
(4)完成酸性高锰酸钾溶液和H2C2O4(已知草酸为弱酸)溶液反应的离子方程式:
(5)该草酸晶体的质量分数为:
考点:中和滴定,探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:(1)KMnO4溶液具有强氧化性,可以腐蚀橡皮管,应装在酸式滴定管中;
(2)草酸反应完毕,加入最后一滴KMnO4溶液,溶液变为红色,红色30s内不褪去,说明滴定到终点;
(3)由关系式2KMnO4~5H2C2O4可知V(KMnO4)?c(KMnO4)=
V(H2C2O4)?c(H2C2O4),即c(H2C2O4)=
,据此分析判断;
(4)酸性高锰酸钾溶液具有强氧化性,能氧化草酸根离子生成二氧化碳,同时自身被还原生成二价锰离子,根据氧化还原反应得失电子守恒配平反应方程式;
(5)由关系式2KMnO4~5H2C2O4计算,注意溶液体积变化.
(2)草酸反应完毕,加入最后一滴KMnO4溶液,溶液变为红色,红色30s内不褪去,说明滴定到终点;
(3)由关系式2KMnO4~5H2C2O4可知V(KMnO4)?c(KMnO4)=
| 2 |
| 5 |
| 5 |
| 2 |
| c(KMnO4)v(KMnO4) |
| V(H2C2O4) |
(4)酸性高锰酸钾溶液具有强氧化性,能氧化草酸根离子生成二氧化碳,同时自身被还原生成二价锰离子,根据氧化还原反应得失电子守恒配平反应方程式;
(5)由关系式2KMnO4~5H2C2O4计算,注意溶液体积变化.
解答:
解:(1)①②KMnO4溶液具有强氧化性,可以腐蚀橡皮管,应装在酸式滴定管中,甲为酸式滴定管,故答案为:甲;
(2)高锰酸钾本身有颜色,故不需要另加指示剂,草酸反应完毕,加入最后一滴KMnO4溶液,溶液变为红色,红色30s内不褪去,说明滴定到终点,
故答案为:加入最后一滴KMnO4溶液,溶液变为红色,且30s内红色不褪去;
(3)由关系式2KMnO4~5H2C2O4可知V(KMnO4)?c(KMnO4)=
V(H2C2O4)?c(H2C2O4),即c(H2C2O4)=
,
A.读取KMnO4溶液体积时,滴定前平视,滴定结束后俯视读数,导致酸性高锰酸钾溶液的体积读数偏小,测定的测定草酸的浓度偏低,故A不符合;
B.滴定管内在滴定前有气泡,滴定后气泡消失,导致酸性高锰酸钾溶液的体积读数偏大,测定的草酸浓度偏高,故B符合;
C.锥形瓶用蒸馏水洗净后润洗,导致草酸的物质的量增加,所用高锰酸钾的体积增大,测定的草酸浓度偏高,故C符合;
D.滴定过程中加入少量蒸馏水冲洗瓶壁,对草酸的物质的量无影响,所用高锰酸钾体积不变,对测定草酸浓度无影响,故D不符合;
故选BC;
(4)酸性高锰酸钾溶液具有强氧化性,能氧化草酸根离子生成二氧化碳,同时自身被还原生成二价锰离子,离子反应为5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O,
故答案为:5H2C2O4+2MnO4-+6H+=1OCO2↑+2Mn2++8H2O;
(5)由关系式 2KMnO4~5H2C2O4可知
2 5
0.1000mol?L-1×0.0200L n
n=0.005mol
100mL草酸溶液中草酸物质的量0.005mol×
=0.02mol
草酸晶体的质量分数=
×100%=90%;
故答案为:90%.
(2)高锰酸钾本身有颜色,故不需要另加指示剂,草酸反应完毕,加入最后一滴KMnO4溶液,溶液变为红色,红色30s内不褪去,说明滴定到终点,
故答案为:加入最后一滴KMnO4溶液,溶液变为红色,且30s内红色不褪去;
(3)由关系式2KMnO4~5H2C2O4可知V(KMnO4)?c(KMnO4)=
| 2 |
| 5 |
| 5 |
| 2 |
| c(KMnO4)v(KMnO4) |
| V(H2C2O4) |
A.读取KMnO4溶液体积时,滴定前平视,滴定结束后俯视读数,导致酸性高锰酸钾溶液的体积读数偏小,测定的测定草酸的浓度偏低,故A不符合;
B.滴定管内在滴定前有气泡,滴定后气泡消失,导致酸性高锰酸钾溶液的体积读数偏大,测定的草酸浓度偏高,故B符合;
C.锥形瓶用蒸馏水洗净后润洗,导致草酸的物质的量增加,所用高锰酸钾的体积增大,测定的草酸浓度偏高,故C符合;
D.滴定过程中加入少量蒸馏水冲洗瓶壁,对草酸的物质的量无影响,所用高锰酸钾体积不变,对测定草酸浓度无影响,故D不符合;
故选BC;
(4)酸性高锰酸钾溶液具有强氧化性,能氧化草酸根离子生成二氧化碳,同时自身被还原生成二价锰离子,离子反应为5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O,
故答案为:5H2C2O4+2MnO4-+6H+=1OCO2↑+2Mn2++8H2O;
(5)由关系式 2KMnO4~5H2C2O4可知
2 5
0.1000mol?L-1×0.0200L n
n=0.005mol
100mL草酸溶液中草酸物质的量0.005mol×
| 100 |
| 25 |
草酸晶体的质量分数=
| 0.02mol×126g/mol |
| 2.80g |
故答案为:90%.
点评:本题考查氧化还原滴定原理与应用、探究影响速率的因素,难度中等,理解实验原理是解题的关键,是对知识的综合运用,需要学生具备扎实的基础知识与运用知识分析问题、解决问题的能力.

练习册系列答案
相关题目
由0.2g氢气,2.8g氮气,0.4g氦气(He),3.2g氧气组成的混合气体在0℃,1.01×105Pa下所占的体积为( )
| A、7.84L |
| B、8.96L |
| C、15.68L |
| D、17.92L |
荧光素(X)常用于钞票等防伪印刷,下列关于它的说法正确的是( )


| A、1molX与足量的NaOH溶液在常温常压下反应,最多消耗3molNaOH |
| B、1molX最多能与9mol氢气反应 |
| C、X与足量的浓溴水反应,最多消耗4molBr2 |
D、X能与糠醛( )发生缩聚反应 )发生缩聚反应 |
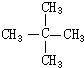 b.CH3CH2CH2CH2CH3 c.CH3CH=CHCH3 d.CH3CH=CH2
b.CH3CH2CH2CH2CH3 c.CH3CH=CHCH3 d.CH3CH=CH2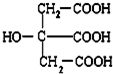
 在高温下,Fe与水蒸气可发生反应.应用右边装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”.请回答该实验中的问题.
在高温下,Fe与水蒸气可发生反应.应用右边装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”.请回答该实验中的问题. 实验室用乙醇制取乙烯的装置如图,回答下列问题.
实验室用乙醇制取乙烯的装置如图,回答下列问题.
